Einführung

Im vorangegangenen Teil wurde hervorgehoben, dass Peptide und Proteine interessante kosmetische Inhaltsstoffe sind, vor allem wegen ihrer Anti-Aging-Aktivität. Es gibt bereits eine Fülle von kosmetischen Rohstoffen auf Peptidbasis auf dem Markt, und weitere werden ständig erforscht.
Bislang bezieht sich die Regulierung dieser Inhaltsstoffe vor allem auf ihre Herkunft (sie müssen synthetisch hergestellt oder extrahiert werden, dürfen aber nicht aus menschlichen Zellen oder anderen Organismen stammen) und auf Werbeaussagen. Meistens sind diese Behauptungen nicht leichtsinnig, sondern mit einer ausgeprägten physiologischen Aktivität verbunden, die oft von Nebenwirkungen begleitet wird, die untersucht werden müssen. In diesem Teil werden die Sicherheitsaspekte von Peptiden und Proteinen erörtert sowie einige allgemeine Regeln, die sicherstellen, dass das Risiko für die menschliche Gesundheit bei der Entwicklung oder Verwendung neuer Peptide und Proteine in kosmetischen Rohstoffen und Produkten begrenzt ist.
Inhaltsstoffe der nächsten Generation gegenüber denen der vorherigen Generation
Aufgrund ihrer potenziellen Bioaktivität sind Peptide und Proteine seit Jahren Gegenstand intensiver medizinischer Forschung. Aspekte ihrer Eigenschaften und ihrer Sicherheit können daher abgeleitet und mit chemisch definierten kleinen Molekülen verglichen werden. Dies gilt auch für Kosmetika, da viele der seit Jahrzehnten verwendeten Inhaltsstoffe chemisch definierte kleine Moleküle sind (Niacinamid, Retinol usw.), während die nächste Generation von Peptiden und Proteinen (Wachstumsfaktoren, Kollagenuntereinheiten usw.) noch nicht so weit ist.
Tabelle 1: Vergleich des Profils zwischen kleinen Molekülen und Peptiden und Proteinen
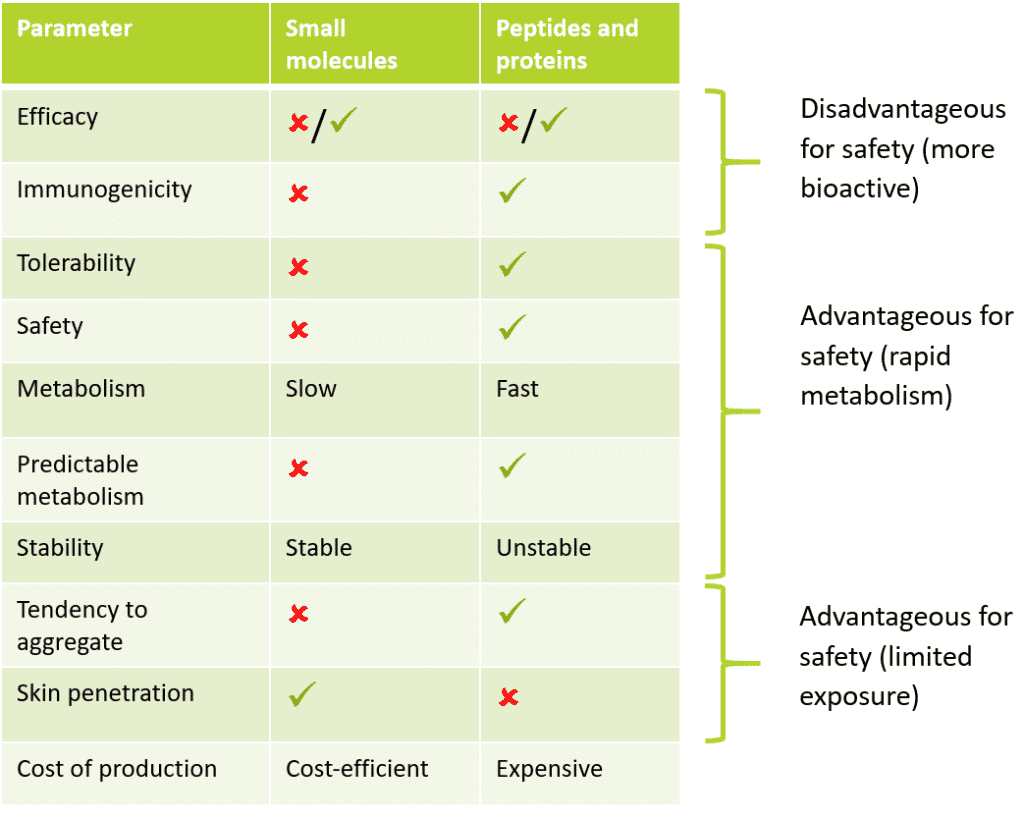
Wie Sie oben sehen, haben Peptide und Proteine eine Reihe von Eigenschaften, die im Vergleich zu kleinen Molekülen für ein besseres Sicherheitsprofil von Vorteil sind. So hat die pharmazeutische Forschung herausgefunden, dass Peptid- und Proteinmedikamente ein besseres Sicherheitsprofil haben und besser verträglich sind als ihre traditionellen niedermolekularen Vorgänger. Dies ist auf den schnellen Metabolismus und die geringere Stabilität zurückzuführen, die zu einer geringeren Bioverfügbarkeit führen, während gleichzeitig weniger Off-Target-Effekte auftreten.
In einem kosmetischen Bereich führt diese geringere Bioverfügbarkeit zu einem geringeren Sicherheitsrisiko. Die Begründung dafür ist das zentrale Dogma der Toxikologie: “Die Dosis macht das Gift” – Paracelsus 1500, der als der Pate der Toxikologie gilt. Die Eigenschaften, die zu einer geringeren Toxizität von Peptiden und Proteinen im Vergleich zu kleinen Molekülen führen, werden im Folgenden für jeden toxikologischen Endpunkt erörtert. Viele dieser Endpunkte bilden die Grundlage für die toxikologische Bewertung eines jeden Inhaltsstoffs.
Absorption, Verteilung, Metabolismus und Ausscheidung

Absorption, Verteilung, Metabolismus und Ausscheidung (oder ADME) sind die wichtigsten Prozesse, die die Exposition gegenüber exogenen Substanzen bestimmen. Bei Kosmetika ist dies vor allem auf die dermale Absorption zurückzuführen, da Kosmetika in der Regel über die Haut aufgetragen werden und die Haut eine wichtige Barriere für exogene Substanzen darstellt.
Die Haut besteht aus verschiedenen Schichten. Die oberste Schicht ist das Stratum corneum, das aus dicht gepackten keratinisierten Zellen besteht, die als wichtige Barriere für das Eindringen großer und/oder hydrophiler Substanzen dienen.
Peptide haben in der Regel ein hohes bis sehr hohes Molekulargewicht und sind bei physiologischem pH-Wert typischerweise geladen, was sie hydrophil macht und somit zu ihrer schlechten passiven Hautpermeation beiträgt. Darüber hinaus enthalten Peptide mehrere Amidbindungen (als Donor- und Akzeptorgruppen für Wasserstoffbrückenbindungen), die ihre Diffusion durch die Haut beeinträchtigen können.
Ein weiterer Aspekt, der Beachtung verdient, ist der Stoffwechsel und die proteolytische Aktivität der Haut, die für die transkutane Verabreichung von Peptiden von Bedeutung sein können. Die Haut enthält Enzymsysteme, die mit denen in anderen Geweben, z.B. der Leber, vergleichbar sind. Endogene Enzyme wie Deaminasen, Esterasen und Aminopeptidasen sind in allen Kompartimenten der Haut zu finden und können zum schnellen Metabolismus von Peptiden und Proteinen beitragen, bevor sie in den systemischen Kreislauf gelangen, vorausgesetzt, diese Peptide und Proteine konnten die Hornschicht überhaupt erst einmal passieren.
Aufgrund der Größe dieser Moleküle und der metabolischen Kapazität der Haut stellt die Haut eine bedeutende Barriere für Peptide und Proteine dar, was zu einer begrenzten systemischen Exposition führt. Ein Beispiel, das dies am besten zeigt, ist vielleicht Pentapeptid-4 (KTTKS), das, obwohl es ein Peptid mit nur 5 Aminosäuren ist, weder in der Rezeptorflüssigkeit noch in einer der Hautschichten (Stratum corneum, Epidermis und Dermis) in haarloser Mäusehaut vorkommt (Choi et al., 2014).
Phototoxizität

Das Potenzial für Phototoxizität kann anhand von In-silico-Parametern ermittelt werden. Zum einen kann der Extinktionskoeffizient – die Fähigkeit einer Substanz, Licht zu absorbieren – als Hinweis auf ein potenzielles Risiko verwendet werden. So gelten beispielsweise Stoffe mit einem Extinktionskoeffizienten von weniger als 1 000 L mol-1 cm-1 als weniger phototoxisch, da es unwahrscheinlich ist, dass dieses niedrige Niveau der Lichtabsorption schädlich ist (Henry et al., 2009). Diese Meinung wird auch von der IHC (International Conference on Harmonisation, 2013) und der Europäischen Arzneimittelagentur (European Medicines Agency, 2011) geteilt.
Speziell für Peptide und Proteine gibt es eine Reihe von webbasierten Tools, die auf der Grundlage des Vorhandenseins von Tyrosin-, Tryptophan- und Cysteinresten – Aminosäuren, die bekanntermaßen Licht absorbieren – Extinktionskoeffizienten vorhersagen können. So kann eine Begrenzung der Tyrosin-, Tryptophan- und Cysteinreste den Extinktionskoeffizienten des Proteins oder Peptids radikal begrenzen und damit das Risiko der Phototoxizität verringern.
Genotoxizität

Im Allgemeinen wird nicht erwartet, dass Peptide und Proteine potenziell genotoxisch sind. In einer seiner Richtlinien (ICH S6(R1)) stellt der ICH (International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use) fest: “Es ist nicht zu erwarten, dass diese Substanzen (Peptide/Proteine) direkt mit DNA oder anderem chromosomalen Material interagieren” (International Conference on Harmonisation, 2011). Dies wurde auch durch andere Studien bestätigt, in denen 78 Proteine auf Genotoxizität getestet wurden, wobei nur vier davon reproduzierbare genotoxische Wirkungen hervorzurufen schienen.
Die Aktivität eines dieser Peptide wurde auf sein Verbindungsmolekül zurückgeführt, während für die übrigen 3 Peptide außer einer potenziellen enzymatischen/hormonellen Aktivität keine klare Begründung gefunden werden konnte. In der Tat kam man zu dem Schluss, dass elektrophile Reaktionen für ein ‘durchschnittliches’ Protein nur schwer vorstellbar sind (Gocke et al., 1999).
Dies zeigt jedoch, dass den Produktionsprozessen, die zur Herstellung dieser Peptide und Proteine verwendet werden, große Aufmerksamkeit geschenkt werden sollte, da einige Reagenzien genotoxisch sein können und Reinigungsschritte in die Produktionsprozesse integriert werden müssen, um die Verschleppung potenzieller Nebenprodukte in das Rohmaterial zu begrenzen.
Sensibilisierung

Die wichtigste Art der Sensibilisierung für kosmetische Produkte ist die Kontaktdermatitis, die als Typ 4-Sensibilisierung eingestuft wird und an der hauptsächlich T-Zellen beteiligt sind. Es ist allgemein anerkannt, dass Hautsensibilisatoren elektrophil sind und mit nukleophilen Gruppen auf Proteinen wie Cystein- und Lysineinheiten reagieren können.
Ein weiterer wichtiger Mechanismus basiert auf freien Radikalreaktionen (Roberts et al., 2012). Da beide Arten von Reaktionen bei dem untersuchten Peptid unwahrscheinlich sind und die Absorption einer solchen Verbindung voraussichtlich gering sein wird, wird das Risiko einer Hautsensibilisierung als gering eingestuft.
Da jedoch viele in Lebensmitteln enthaltene Proteine und Peptide auch als Allergene dienen, sollten Proteine und Peptide, die in Kosmetika verwendet werden, auf diese Art von Allergenität geprüft werden. Insbesondere die unmittelbare Überempfindlichkeit, wie Allergie und Anaphylaxie, beruht auf anderen Mechanismen als die Kontaktdermatitis.
Bei einer Sensibilisierung vom Typ 1 sind die Effektorzellen meist Antikörper produzierende Zellen wie Mastzellen und IgE-Antikörper. Aus den wissenschaftlichen Stellungnahmen des SCCS und des CIR zu hydrolysierten Weizenproteinen geht jedoch hervor, dass Peptide mit einem Molekulargewicht unter 3,5 kDa eine geringe Sensibilisierungskapazität haben (SCCS, 2014). Damit eine Sensibilisierungsreaktion vom Typ 1 auftritt, muss ein Allergen zwei IgE-Antikörper binden. Daher muss ein Allergen mindestens zwei IgE-Bindungsstellen mit einer Länge von jeweils mindestens 15 Aminosäuren enthalten. Dies bedeutet, dass die Mindestgröße für Proteinallergene etwa 30 Aminosäuren beträgt (Huby, 2000).
Potenzielle Gefahr für die menschliche Gesundheit

Ausgehend von dem oben Gesagten könnte man annehmen, dass Peptide und Proteine keine signifikanten toxikologischen Profile aufweisen, was jedoch falsch wäre. In der Tat können Peptide und Proteine eine Gefahr für die menschliche Gesundheit darstellen, die durch die Bioverfügbarkeit und eine übertriebene Pharmakologie bedingt ist. So werden beispielsweise Proteine in Form von Rezeptoren und Enzymen als funktionelle Einheit betrachtet, die die normalen Körperfunktionen ermöglicht. Das Gleiche gilt für Peptide, die Signalmoleküle enthalten. Wenn also durch eine erhöhte oder verringerte Aktivität ein Ungleichgewicht in der Homöostase entsteht, könnte dies zu negativen Auswirkungen führen. Die Identifizierung solcher “übertriebener pharmakologischer” Ereignisse ist jedoch bei den derzeitigen Sicherheitstests nicht einfach.
Um eine potenzielle Gefahr für die menschliche Gesundheit zu erkennen, und angesichts der Tatsache, dass Proteine und Peptide eine Kaskade von biologischen Ereignissen auslösen können, die zu einer nachteiligen Wirkung führen können, ist ein ganzheitlicher Ansatz erforderlich. Man könnte sich vorstellen, dass Omics-Technologien der nächsten Generation dabei eine große Hilfe wären. Kurz gesagt, diese Technologien ermöglichen einen umfassenden Überblick über molekulare Ereignisse auf Gen- und Proteinebene. Sobald ein Netzwerk betroffener Gene und/oder Proteine identifiziert ist, können diese mit molekularen Wirkmechanismen in Verbindung gebracht werden, von denen bekannt ist, dass sie schädliche Auswirkungen auf die Gesundheit haben. Dies steht im Einklang mit dem Adverse Outcomes Pathway (AOP)-Ansatz, bei dem schädliche Auswirkungen auf die Gesundheit aus molekularen auslösenden Ereignissen vorhergesagt werden, ein Ansatz, der in der regulatorischen Toxikologie stark an Bedeutung gewinnt. Um dies erfolgreich umzusetzen, müssen die Fähigkeiten in diesen Bereichen ausgebaut werden, wobei gleichzeitig sichergestellt werden muss, dass die Tests nicht zu kostspielig sind. Darüber hinaus wurden einige AOPs bereits entwickelt und validiert, während sich andere in verschiedenen Stadien der Akzeptanz und Entwicklung befinden. In der Tat ist noch viel Arbeit nötig, um toxikologische Molekularwege als AOPs abzubilden. Da eine Gefährdung der menschlichen Gesundheit mit diesen Ansätzen noch nicht ohne weiteres festgestellt werden kann, wird die Unsicherheit durch die Gewährleistung der begrenzten Bioverfügbarkeit dieser kosmetischen Inhaltsstoffe gesteuert.
Fazit

Wie oben beschrieben, profitieren Peptide und Proteine von einer Reihe von Eigenschaften, die das Gesundheitsrisiko begrenzen könnten. Diese Eigenschaften sind besonders wichtig im Hinblick auf das Verbot von Tierversuchen für kosmetische Inhaltsstoffe. Um diese Eigenschaften beizubehalten, sollten jedoch wesentliche Änderungen an diesen Zutaten vermieden werden. Dazu gehören in Kürze:
- Keine umfangreiche Modifikation, um die Absorption signifikant zu erhöhen – dies dient der Aufrechterhaltung des zentralen Dogmas der Toxikologie: begrenzte Exposition = begrenztes Risiko
- Begrenzte Modifikationen an Aminosäuren – es wird davon ausgegangen, dass natürliche Aminosäuren weder genotoxisch, noch karzinogen oder reproduktionstoxisch sind, da sie schnell metabolisiert werden.
- Begrenzen Sie die Menge an Tyrosin-, Tryptophan- und Cysteinrückständen – Begrenzen Sie das Potenzial für Phototoxizität
- Aufnahme von Reinigungsschritten in den Produktionsprozess – um die Verschleppung von potenziell gefährlichen Verunreinigungen zu begrenzen
Diese Überlegungen sind wichtig angesichts des Verbots von Tierversuchen für kosmetische Inhaltsstoffe, bei denen Toxikologen auf andere Daten und Instrumente als die traditionellen toxikologischen Tierversuche zurückgreifen müssen. Wie bereits in Teil I erwähnt, werden Kosmetika und Arzneimittel außerdem anhand ihres Verwendungszwecks unterschieden, der in erster Linie von ihren Angaben bestimmt wird. Auf der Grundlage des Handbuchs der Arbeitsgruppe für kosmetische Mittel zu Borderline-Produkten werden Substanzen, die physiologische Funktionen wiederherstellen, korrigieren oder modifizieren, indem sie pharmakologische Wirkungen ausüben, jedoch “aufgrund ihrer Aufmachung” (also wie oben beschrieben) oder “aufgrund ihrer Funktion” identifiziert. Letzteres wird “unter Berücksichtigung aller Eigenschaften des Produkts, einschließlich Absorption, Konzentration, Verabreichungsweg, Häufigkeit der Anwendung, Anwendungsort und Grad der Penetration” bewertet. Daher ist es wichtig zu verstehen, wie die Eigenschaften von Peptiden und Proteinen zusammenwirken, um toxikologische Profile zu erstellen und zu bestimmen, ob es sich bei einem Inhaltsstoff um ein Medikament oder ein Kosmetikum handelt.
Referenzen
Choi, Y.L., Park, E.J., Kim, E., Na, D.H., and Shin, Y.H. (2014). Dermale Stabilität und in vitro Hautpermeation von Kollagen-Pentapeptiden (KTTKS und Palmitoyl-KTTKS). Biomol. Ther. 22, 321-327.
Europäische Arzneimittel-Agentur (2011). Fragen und Antworten zum ‘Hinweis zur Anleitung von Fotosicherheitstests’.
Gocke, E., Albertini, S., Brendler-Schwaab, S., Müller, L., Suter, W., und Würgler, F.E. (1999). Genotoxizitätstests für biotechnologisch hergestellte Produkte: Bericht einer GUM-Arbeitsgruppe. Mutat. Res. – Rev. Mutat. Res. 436, 137-156.
Henry, B., Foti, C., und Alsante, K. (2009). Können Daten zur Lichtabsorption und Photostabilität verwendet werden, um die Risiken der Photosicherheit eines neuen Arzneimittelmoleküls für Patienten zu bewerten? J. Photochem. Photobiol. B Biol. 96, 57-62.
Huby, R.D.J. (2000). Warum sind manche Proteine Allergene? Toxicol. Sci. 55, 235-246.
Internationale Konferenz über Harmonisierung (2011). Präklinische Sicherheitsbewertung von biotechnologisch hergestellten Arzneimitteln.
Internationale Konferenz über Harmonisierung (2013). Bewertung der Fotosicherheit von Arzneimitteln.
Roberts, D.W., Basketter, D., Kimber, I., White, J., McFadden, J., und White, I.R. (2012). Natriummetabisulfit als Kontaktallergen – ein Beispiel für einen seltenen chemischen Mechanismus zur Proteinmodifikation. Kontaktdermatitis 66, 123-127. SCCS (2014). Stellungnahme zu hydrolysierten Weizenproteinen.
Dieser Artikel wurde von Dr. Boris Krivoshiev, ehemaliger leitender Toxikologe, während seiner Zeit bei BIORIUS geschrieben.


