はじめに

前回の記事では、ペプチドとタンパク質が、特にアンチエイジング作用を持つことから、化粧品原料として注目されていることを紹介しました。ペプチドをベースにした化粧品原料は、すでに市場に数多く存在し、常に研究が行われています。
これまでのところ、これらの成分の規制は、その起源(ヒト細胞および他の生物からではなく、合成または抽出されなければならない)およびマーケティング・クレームに基づいています。ほとんどの場合、これらのクレーム(=効果・効能)は軽いものではなく、生理学的活性とのバランスが取れており、しばしば調査すべき副作用を伴います。今回の記事では、ペプチドとタンパク質の安全性の側面について説明し、新しいペプチドやタンパク質を化粧品の原材料や製品に開発または使用する際に、人の健康に対するリスクを限定的にするためのいくつかの一般的なルールを紹介します。
次世代成分と旧世代成分の比較
ペプチドとタンパク質は、その潜在的な生物活性が考慮されたことにより、長年にわたって熱心な医学研究の対象となってきました。そのため、その特性や安全性については、化学的に定義された低分子と比較することができます。これは化粧品にも共通しており、数十年にわたって使用されてきた多くの成分は、化学的に定義された低分子(ナイアシンアミド、レチノールなど)であり、次世代のペプチドやタンパク質(成長因子、コラーゲンサブユニットなど)と比較されます。
表1:低分子化合物とペプチドやタンパク質のプロファイル比較
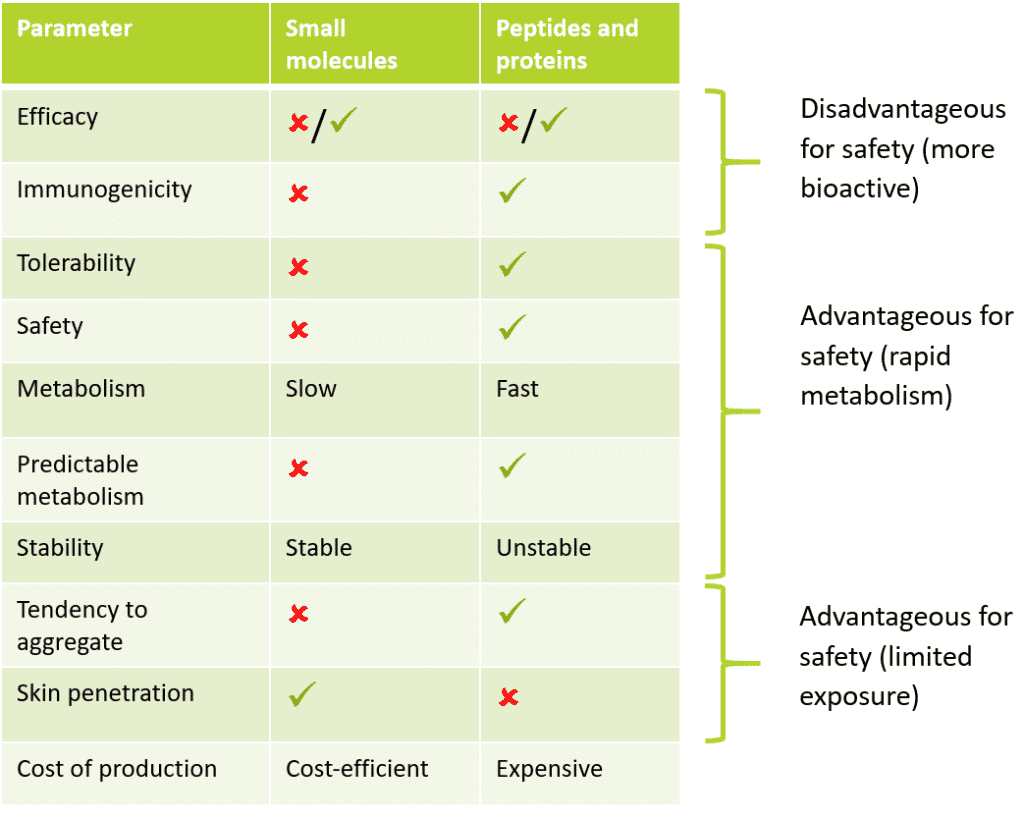
上記のように、ペプチドやタンパク質には、低分子化合物と比較して、安全性の向上に有益な多くの固有特性があります。例えば、製薬会社の研究によると、ペプチドやタンパク質の医薬品は、従来の低分子医薬品に比べて安全性が高く、耐用性も高いことがわかっています。これは、代謝が速く、安定性が低いため、バイオアベイラビリティー(bioavailability)が低下する一方で、オフターゲット効果が少ないことが原因です。
化粧品の分野では、このバイオアベイラビリティの低さが安全性に対するリスクの低下につながります。その根拠となるのが、毒物学の中心的な「ドグマ」(つまり、1500年代に毒物学のゴッドファーザーと呼ばれたパラケルススが唱えた「量は毒を作る」という言葉)がその根拠となっています。低分子化合物と比較してペプチドやタンパク質の毒性が低いことを示す特性については、毒性評価項目ごとに以下で説明しますが、これらの評価項目の多くは、あらゆる成分の毒性評価の基礎となるものです。
吸収、分布、代謝、排泄(ADME)

吸収、分布、代謝、排泄(ADME:Absorption, distribution, metabolism, and excretion)は、外因性物質への曝露を規定する主なプロセスです。化粧品の場合、通常、皮膚に塗布されますが、皮膚は外因性物質に対する重要なバリアーであることから、このプロセスは主に経皮吸収によって引き起こされます。
皮膚は様々な層で構成されていますが、最上部にある角質層は、大きな物質や親水性物質の侵入を防ぐ重要なバリアーとして、角質細胞が密に詰まって構成されています。
ペプチドは一般的に高分子量から超高分子量であり、生理的なpHでは一般的に電荷を帯びているため親水性となり、受動的な皮膚透過性が悪くなります。さらに、ペプチドには複数のアミド結合(水素結合のドナーおよびアクセプター基)があるため、皮膚上での拡散に影響を与える可能性があります。
もう1つの考慮すべき点は、ペプチドを経皮的に送達する際に重要となる皮膚の代謝と、タンパク質分解活性です。皮膚には、例えば肝臓などの他の組織で見られるものと同等の酵素システムが存在します。デアミナーゼ、エステラーゼ、アミノペプチダーゼなどの内因性酵素は、皮膚のすべての部位に存在し、ペプチドやタンパク質が角質層を最初に通過できたと仮定すると、全身循環に入る前にペプチドやタンパク質の迅速な代謝に寄与すると考えられています。
このように、ペプチドやタンパク質はその分子の大きさや皮膚の代謝能力から、皮膚が重要なバリアーとなり、全身への曝露が制限されることになります。例えば、ペンタペプチド-4(KTTKS)は、わずか5アミノ酸のペプチドであるにもかかわらず、ヘアレスマウスの皮膚の受容体液や皮膚層(角質層、表皮層、真皮層)のいずれにも存在しないことが確認されています(Choi et al., 2014)。
光毒性

光毒性の可能性は、in silico(=コンピューターシミュレーション)のパラメータに基づいて特定することができます。例えば、物質が光を吸収する能力である消衰係数を潜在的なリスクの指標として用います。例として、消光係数が1 000 L mol-1 cm-1未満の物質は、このような低レベルの光吸収では有害性が証明される可能性が低いため、光毒性リスクが低いと考えられます(Henry et al., 2009)。この見解はIHC(International Conference on Harmonisation, 2013)や欧州医薬品庁(European Medicines Agency, 2011)でも共有されています。
特にペプチドやタンパク質については、光を吸収することが知られているアミノ酸であるチロシン、トリプトファン、システイン残基の存在に基づいて消光係数を予測するウェブベースのツールが数多く存在します。これらの残基を制限することで、タンパク質やペプチドの消光係数を大幅に制限することができ、光毒性のリスクを抑えることができます。
遺伝毒性

一般的に、ペプチドやタンパク質は遺伝毒性を示さないと考えられています。医薬品規制調和国際会議(ICH:International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use)は、そのガイドラインの一つであるICH S6(R1)において、「これらの物質(ペプチド/タンパク質)がDNAや他の染色体物質と直接相互作用することは予想されない」と述べています(International Conference on Harmonisation, 2011)。これは、他の研究でも確認されており、78種類のタンパク質について遺伝毒性試験を行ったところ、再現性のある遺伝毒性作用を示したのはわずか4種類でした。
これらのペプチドのうち1つの活性は、リンカー分子に起因するものであり、残りの3つのペプチドについては、酵素/ホルモン活性の可能性を除いては、明確な根拠は得られませんでした。実際、「平均的な」タンパク質では、親電子反応を想定することは困難であると結論づけられています(Gocke et al., 1999)。
とはいえ、試薬の中には遺伝毒性を持つものもあるため、これらのペプチドやタンパク質を製造する際には、製造工程に細心の注意を払う必要があります。また、副産物となる可能性のある物質が原材料へキャリーオーバーするのを抑えるために、製造工程に精製ステップを組み込む必要があります。
感作性

化粧品に対する最も重要な感作性タイプは接触皮膚炎であり、これはタイプ4の感作に分類され、主にT細胞が関与します。皮膚感作性物質は親電性であり、システインやリジンなどのタンパク質の求核性基と反応することが一般的に認められています。
もう1つの重要なメカニズムは、フリーラジカル反応に基づくものです(Roberts et al., 2012)。調査対象のペプチドではこの2つの反応は起こり得ず、また、このような化合物の吸収率は低いと予想されることから、皮膚感作のリスクは低いと考えられます。
しかし、食品に含まれる多くのタンパク質やペプチドがアレルゲンとなることを考えると、化粧品に使用されるタンパク質やペプチドもこの種のアレルゲン性を評価する必要があります。特に、アレルギーやアナフィラキシーなどの即時型過敏症は、接触性皮膚炎とは異なるメカニズムで発症します。
タイプ1の感作では、エフェクター細胞はマスト細胞やIgE抗体などの抗体産生細胞が中心となります。しかし、加水分解コムギタンパクに関するSCCSとCIRの科学的意見から、分子量3.5kDa以下のペプチドは感作性が低いことが明らかになっています(SCCS, 2014)。このように、タイプ1の感作反応が起こるためには、アレルゲンが2つのIgE抗体と結合しなければなりません。そのため、アレルゲンには少なくとも2つのIgE結合部位があり、それぞれが15アミノ酸以上の長さを持っていなければなりません。このことは、タンパク質アレルゲンの最小サイズが約30アミノ酸であることを意味します(Huby, 2000)。
人の健康に対する潜在的な危険性

上述した内容に基づいて、ペプチドやタンパク質は重大な毒性プロファイルを持たないと思われるかもしれませんが、それは間違いです。実際には、ペプチドやタンパク質は、バイオアベイラビリティや誇張された薬理学(exaggerated pharmacology)に基づいて、人間の健康に害を及ぼす可能性があります。例えば、受容体や酵素の形をしたタンパク質は、正常な身体機能を促進する機能単位と考えられています。同じことが、シグナリング分子を含むペプチドにも当てはまります。そのため、活性の増減によってホメオスタシスのバランスが崩れると、悪影響が生じる可能性があります。しかし、このような「薬理学的に誇張された」事象を特定することは、現在の安全性試験のアプローチでは容易ではありません。
人の健康に影響を及ぼす可能性のある危険性を特定するためには、全体的なアプローチが必要となります。なぜなら、タンパク質やペプチドの性質上、悪影響を及ぼす可能性のある生物学的事象が連鎖的に発生する可能性があるからです。全体的なアプローチには、次世代オミックス技術が大いに役立つと考えられます。次世代オミックス技術とは、遺伝子やタンパク質のレベルで発生している分子イベントを包括的に把握できる技術です。影響を受ける遺伝子やタンパク質のネットワークが特定されれば、健康への悪影響を引き起こすことがわかっている分子作用に結びつけることができます。これは、有害事象経路(Adverse Outcomes Pathway: AOP)に沿ったもので、分子レベルの開始事象から末端の有害な健康被害を予測するものとして、規制毒物学では大いに注目されているアプローチです。このアプローチを成功させるためには、これらの分野のスキルを向上させることが必要であると同時に、試験がコスト的に不利にならないようにする必要があります。さらに、AOPの中には開発・検証されているものもあれば、開発段階のものあります。実際、毒性のある分子経路をAOPとしてマッピングするには、まだかなりの作業が必要です。このように、これらのアプローチではまだ人の健康に対する危険性が容易に特定できないことから、化粧品成分の限られたバイオアベイラビリティを確保することで不確実性を管理しています。
結論

上述したように、ペプチドやタンパク質には、健康リスクを抑えることができる多くの特性があります。これらの特性は、化粧品原料の動物実験禁止の観点から、特に重要です。しかしながら、これらの特性を維持するためには、成分に大幅な変更を加えることは避けなければなりません。これらを簡単に説明すると:
- 吸収率を大幅に高めるような大規模な改造は行わない。これは、毒性学の中心的なドグマである「限られた暴露=限られたリスク」を維持するためである。
- アミノ酸への改変を制限すること。天然アミノ酸は、急速に代謝されながらも、遺伝毒性、発がん性、生殖毒性を持たないと考えられています。
- チロシン、トリプトファン、システイン残基の量の制限、つまり、光毒性の可能性の制限すること。
- 製造工程に精製工程を組み込むことで、潜在的に危険な不純物のキャリーオーバーを抑制する。
化粧品成分の動物実験が禁止され、毒物学者が従来の動物実験以外のデータやツールに頼らざるを得なくなったことを考えると、こうした配慮は重要です。さらに、前回の記事で述べたように、化粧品と医薬品は、主に謳い文句(=クレーム)にある使用目的に基づいて区別されています。しかし、化粧品ワーキンググループの「ボーダーライン製品」に関するマニュアルによると、薬理作用を発揮して生理機能を回復・修正・変更する物質は、「表示効能」(つまり上記のような主張)で識別されるか、「機能効能」で識別されるとしています。後者は、「吸収性、濃度、投与経路、適用頻度、適用部位、浸透の程度など、製品のあらゆる特性を考慮して評価する」とされています。このように、ある成分が医薬品であるか化粧品であるかを判断する際には、ペプチドとタンパク質の特性がどのように絡み合って毒性プロファイルを主動するかを理解することの役割が大切になります。
参考文献
Choi, Y.L., Park, E.J., Kim, E., Na, D.H., and Shin, Y.H. (2014). Dermal stability and in vitro skin permeation of collagen pentapeptides (KTTKS and palmitoyl-KTTKS). Biomol. Ther. 22, 321–327.
European Medicines Agency (2011). Questions and answers on the ‘ Note for guidance of photosafety testing.’
Gocke, E., Albertini, S., Brendler-Schwaab, S., Müller, L., Suter, W., and Würgler, F.E. (1999). Genotoxicity testing of biotechnology-derived products: Report of a GUM task force. Mutat. Res. – Rev. Mutat. Res. 436, 137–156.
Henry, B., Foti, C., and Alsante, K. (2009). Can light absorption and photostability data be used to assess the photosafety risks in patients for a new drug molecule? J. Photochem. Photobiol. B Biol. 96, 57–62.
Huby, R.D.J. (2000). Why Are Some Proteins Allergens? Toxicol. Sci. 55, 235–246.
International Conference on Harmonisation (2011). Preclinical safety evaluation of biotechnology-derived pharmaceuticals.
International Conference on Harmonisation (2013). Photosafety evaluation of pharmaceuticals.
Roberts, D.W., Basketter, D., Kimber, I., White, J., McFadden, J., and White, I.R. (2012). Sodium metabisulfite as a contact allergen–an example of a rare chemical mechanism for protein modification. Contact Dermatitis 66, 123–127. SCCS (2014). Opinion on hydrolysed wheat proteins.
This article was written by Dr. Boris Krivoshiev, former Principal Toxicologist, during his time at BIORIUS.

