Introduction

Dans la partie précédente, il a été souligné que les peptides et les protéines sont des ingrédients cosmétiques intéressants, notamment en raison de leurs activités anti-âge. Il existe déjà une pléthore de matières premières cosmétiques à base de peptides sur le marché, et d’autres font l’objet de recherches constantes.
Jusqu’à présent, la réglementation de ces ingrédients porte essentiellement sur leur origine (ils doivent être synthétisés ou extraits, mais ne doivent pas provenir de cellules humaines ou d’autres organismes) et sur les allégations commerciales. La plupart du temps, ces affirmations ne sont pas frivoles mais correspondent à une activité physiologique prononcée, souvent accompagnée d’effets secondaires qui doivent être étudiés. Dans cette partie, les aspects liés à la sécurité des peptides et des protéines seront abordés, ainsi que plusieurs règles générales visant à garantir un risque limité pour la santé humaine lors du développement ou de l’utilisation de nouveaux peptides et protéines dans les matières premières et les produits cosmétiques.
Ingrédients de la prochaine génération ou de la génération précédente
Compte tenu de leur bioactivité potentielle, les peptides et les protéines ont fait l’objet d’intenses recherches médicales au fil des ans. Les aspects relatifs à leurs propriétés et à leur sécurité peuvent donc être tirés et comparés à des petites molécules définies chimiquement. Ceci est également analogue aux cosmétiques, puisque de nombreux ingrédients utilisés au cours des décennies sont de petites molécules définies chimiquement (niacinamide, rétinol, etc.), par rapport à la nouvelle génération de peptides et de protéines (facteurs de croissance, sous-unités de collagène, etc.).
Tableau 1 : Comparaison du profil des petites molécules avec celui des peptides et des protéines
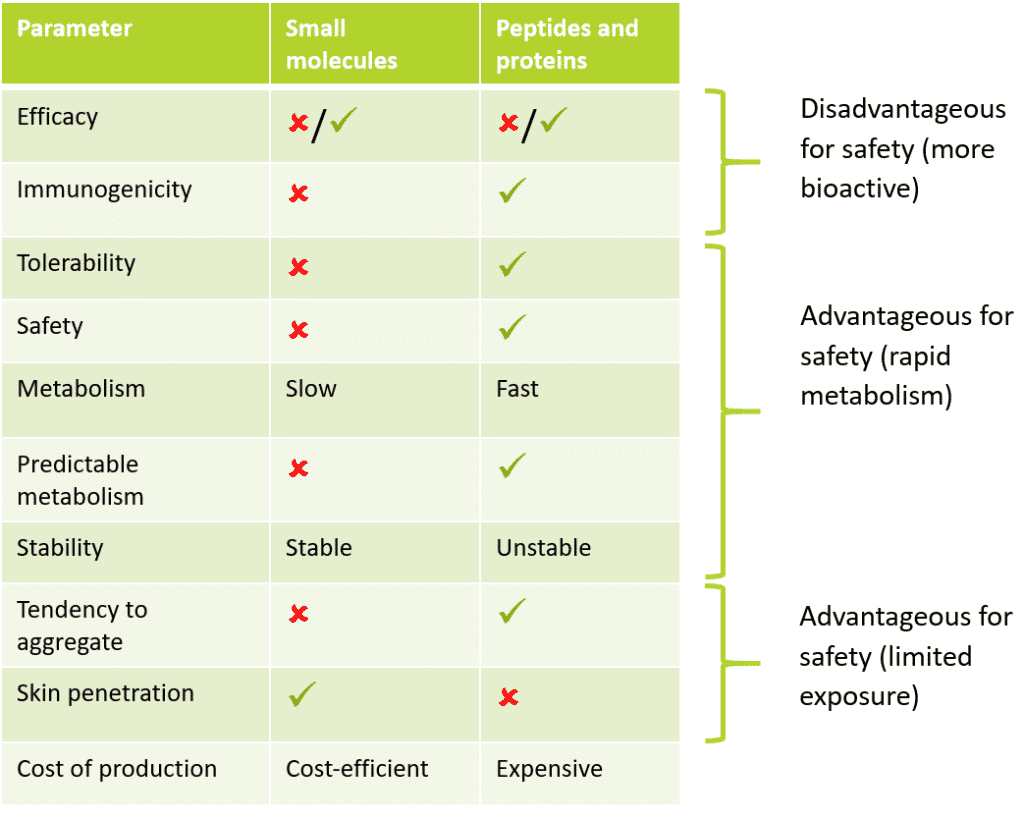
Comme on peut le voir ci-dessus, les peptides et les protéines possèdent un certain nombre de propriétés intrinsèques qui leur permettent d’améliorer leur profil de sécurité par rapport aux petites molécules. Par exemple, la recherche pharmaceutique a montré que les médicaments à base de peptides et de protéines avaient un meilleur profil de sécurité et étaient mieux tolérés que leurs prédécesseurs traditionnels à base de petites molécules. Cela est dû à un métabolisme rapide et à une stabilité réduite qui entraînent une diminution de la biodisponibilité tout en maintenant moins d’effets hors cible.
Dans le domaine des cosmétiques, cette biodisponibilité réduite entraîne une diminution du risque pour la sécurité. La raison en est le dogme central de la toxicologie : “la dose fait le poison” – Paracelse (1500), considéré comme le parrain de la toxicologie : “Paracelse (1500), considéré comme le parrain de la toxicologie. Les propriétés qui permettent de réduire la toxicité des peptides et des protéines par rapport à celle des petites molécules seront examinées ci-dessous par effet toxicologique, nombre de ces effets constituant la base de l’évaluation toxicologique de n’importe quel ingrédient.
Absorption, distribution, métabolisme et excrétion

L’absorption, la distribution, le métabolisme et l’excrétion (ou ADME) sont les principaux processus qui définissent l’exposition aux substances exogènes. En ce qui concerne les cosmétiques, ce phénomène est principalement dû à l’absorption cutanée, étant donné que les cosmétiques sont normalement appliqués par voie cutanée et que la peau constitue en fait une barrière importante pour les substances exogènes.
La peau est constituée de plusieurs couches, la plus haute étant la couche cornée, composée de cellules kératinisées très serrées qui constituent une barrière importante à l’entrée de substances volumineuses et/ou hydrophiles.
Les peptides ont généralement un poids moléculaire élevé, voire très élevé, et sont généralement chargés à un pH physiologique, ce qui les rend hydrophiles, contribuant ainsi à leur faible perméation cutanée passive. En outre, les peptides contiennent de multiples liaisons amides (en tant que groupes donneurs et accepteurs de liaisons hydrogène) qui peuvent affecter leur diffusion à travers la peau.
Un autre aspect méritant d’être pris en considération est le métabolisme et l’activité protéolytique de la peau, qui peuvent jouer un rôle important dans l’administration transcutanée de peptides. La peau contient des systèmes enzymatiques comparables à ceux que l’on trouve dans d’autres tissus, par exemple le foie. Les enzymes endogènes telles que les désaminases, les estérases et les aminopeptidases sont présentes dans tous les compartiments de la peau et peuvent contribuer au métabolisme rapide des peptides et des protéines avant qu’ils ne pénètrent dans la circulation systémique, à supposer que ces peptides et ces protéines aient pu traverser la couche cornée au départ.
En tant que telle, la peau constitue une barrière importante pour les peptides et les protéines en raison de la taille de ces molécules et de la capacité métabolique de la peau, ce qui conduit à une exposition systémique limitée. Le pentapeptide-4 (KTTKS), qui est un peptide de seulement 5 acides aminés, est un exemple qui illustre bien ce phénomène. On a constaté qu’il n’était pas présent dans le liquide récepteur ni dans aucune des couches de la peau (couche cornée, épiderme et derme) de la peau de souris glabre (Choi et al., 2014).
Phototoxicité

Le potentiel de phototoxicité peut être identifié sur la base de paramètres in silico. Le coefficient d’extinction, c’est-à-dire la capacité d’une substance à absorber la lumière, peut par exemple être utilisé comme indication d’un risque potentiel. Par exemple, les substances dont le coefficient d’extinction est inférieur à 1 000 L mol-1 cm-1 sont considérées comme présentant un risque phototoxique moindre, car il est peu probable que ce faible niveau d’absorption de la lumière se révèle nocif (Henry et al., 2009). Cet avis est également partagé par l’IHC (International Conference on Harmonisation, 2013) et l’Agence européenne des médicaments (European Medicines Agency, 2011).
En ce qui concerne les peptides et les protéines, il existe un certain nombre d’outils en ligne capables de prédire les coefficients d’extinction en fonction de la présence de résidus de tyrosine, de tryptophane et de cystéine, des acides aminés connus pour leur capacité à absorber la lumière. Ainsi, la limitation des résidus de tyrosine, de tryptophane et de cystéine peut limiter radicalement le coefficient d’extinction de la protéine ou du peptide et donc limiter le risque de phototoxicité.
Génotoxicité

En général, les peptides et les protéines ne devraient pas être potentiellement génotoxiques. Dans l’une de ses lignes directrices (ICH S6(R1)), l’ICH (International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use) indique que “l’on ne s’attend pas à ce que ces substances (peptides/protéines) interagissent directement avec l’ADN ou d’autres matériaux chromosomiques” (International Conference on Harmonisation, 2011). Ceci a été confirmé par d’autres études dans lesquelles 78 protéines ont été testées pour la génotoxicité et seules quatre d’entre elles ont semblé provoquer des effets génotoxiques reproductibles.
L’activité de l’un de ces peptides a été attribuée à sa molécule de liaison, tandis qu’aucune justification claire n’a pu être établie pour les trois autres peptides, à l’exception d’une activité enzymatique/hormonale potentielle. En fait, il a été conclu que pour la protéine “moyenne”, les réactions électrophiles sont difficiles à envisager (Gocke et al., 1999).
Néanmoins, cela montre qu’une attention particulière doit être accordée aux processus de production utilisés pour produire ces peptides et protéines, car certains réactifs peuvent être génotoxiques, tandis que des étapes de purification doivent être incorporées dans les processus de production afin de limiter le transfert de sous-produits potentiels vers la matière première.
Sensibilisation

Le type de sensibilisation le plus important pour les produits cosmétiques est la dermatite de contact, qui est classée comme une sensibilisation de type 4 et implique principalement les cellules T. Il est généralement admis que les sensibilisants cutanés sont électrophiles et capables de réagir avec les groupes nucléophiles des protéines, tels que les unités de cystéine et de lysine.
Un autre mécanisme important est basé sur les réactions radicales libres (Roberts et al., 2012). Étant donné que ces deux types de réactions sont peu probables avec le peptide étudié et que l’absorption de ce composé devrait être faible, le risque de sensibilisation cutanée est considéré comme faible.
Toutefois, étant donné que de nombreuses protéines et peptides présents dans les aliments servent également d’allergènes, les protéines et peptides utilisés dans les cosmétiques méritent d’être évalués pour ce type d’allergénicité. Plus précisément, l’hypersensibilité immédiate, telle que l’allergie et l’anaphylaxie, implique des mécanismes différents de ceux de la dermatite de contact.
Dans la sensibilisation de type 1, les cellules effectrices sont principalement des cellules productrices d’anticorps telles que les mastocytes et les anticorps IgE. Toutefois, les avis scientifiques du SCCS et du CIR sur les protéines de blé hydrolysées montrent clairement que les peptides d’un poids moléculaire inférieur à 3,5 kDa ont une faible capacité de sensibilisation (SCCS, 2014). Ainsi, pour qu’une réaction de sensibilisation de type 1 se produise, un allergène doit lier deux anticorps IgE. Par conséquent, un allergène doit contenir au moins deux sites de liaison aux IgE, chacun d’une longueur minimale de 15 acides aminés. Cela implique que la taille minimale des allergènes protéiques est d’environ 30 acides aminés (Huby, 2000).
Risque potentiel pour la santé humaine

Sur la base de ce qui a été discuté ci-dessus, on pourrait supposer que les peptides et les protéines n’ont pas de profils toxicologiques significatifs, ce qui serait incorrect. En fait, les peptides et les protéines peuvent présenter des risques pour la santé humaine en raison de leur biodisponibilité et de leur pharmacologie exagérée. Par exemple, les protéines sous forme de récepteurs et d’enzymes sont considérées comme l’unité fonctionnelle qui facilite les fonctions corporelles normales. Il en va de même pour les peptides qui comprennent des molécules de signalisation. Ainsi, si un déséquilibre de l’homéostasie devait se produire en raison d’une augmentation ou d’une diminution de l’activité, des effets néfastes pourraient survenir. Cependant, l’identification de ces événements “pharmacologiques exagérés” n’est pas facile dans les approches actuelles des tests de sécurité.
Pour identifier les risques potentiels pour la santé humaine, et compte tenu de la nature des protéines et des peptides en ce sens qu’une cascade d’événements biologiques peut se produire et entraîner un effet néfaste, une approche holistique est nécessaire. Pour ce faire, on pourrait envisager que les technologies omiques de la prochaine génération soient d’un grand secours. En bref, ces technologies permettent d’obtenir une vue d’ensemble des événements moléculaires qui se produisent au niveau des gènes et des protéines. Une fois qu’un réseau de gènes et/ou de protéines affectés est identifié, il peut être lié à des modes d’action moléculaires dont on sait qu’ils entraînent des effets néfastes sur la santé. Cette démarche s’inscrit dans le droit fil de l’approche AOP (Adverse Outcomes Pathway), qui consiste à prédire les effets nocifs sur la santé à partir d’événements moléculaires initiateurs, une approche qui gagne considérablement en popularité dans le domaine de la toxicologie réglementaire. Pour réussir cette mise en œuvre, il faudrait développer les compétences dans ces domaines, tout en veillant à ce que le coût des tests ne soit pas prohibitif. En outre, certaines AOP ont été développées et validées, tandis que d’autres en sont à différents stades d’acceptation et de développement. En fait, il reste encore beaucoup à faire pour cartographier les voies moléculaires toxicologiques en tant qu’AOP. Ainsi, étant donné que le danger pour la santé humaine ne peut pas encore être facilement identifié à l’aide de ces approches, l’incertitude est gérée en garantissant la biodisponibilité limitée de ces ingrédients cosmétiques.
Conclusion

Comme décrit ci-dessus, les peptides et les protéines bénéficient d’un certain nombre de propriétés qui pourraient limiter les risques pour la santé. Ces propriétés sont particulièrement importantes à la lumière de l’interdiction des tests sur les animaux pour les ingrédients cosmétiques. Néanmoins, des modifications significatives de ces ingrédients doivent être évitées afin de maintenir ces caractéristiques. En bref, il s’agit des éléments suivants
- Pas de modification importante pour augmenter significativement l’absorption – cela permet de maintenir le dogme central de la toxicologie : exposition limitée = risque limité.
- Modifications limitées des acides aminés – les acides aminés naturels ne devraient pas être génotoxiques, cancérigènes ou toxiques pour la reproduction tout en étant rapidement métabolisés.
- Limiter la quantité de résidus de tyrosine, de tryptophane et de cystéine – limiter le potentiel de phototoxicité
- Inclure des étapes de purification dans les processus de production – pour limiter le transfert d’impuretés potentiellement dangereuses
Ces considérations sont importantes à la lumière de l’interdiction de l’expérimentation animale pour les ingrédients cosmétiques, où les toxicologues doivent s’appuyer sur des données et des outils autres que les tests toxicologiques traditionnels sur les animaux. En outre, comme indiqué dans la première partie, les cosmétiques et les médicaments sont distingués en fonction de l’usage auquel ils sont destinés, qui est principalement déterminé par les allégations qu’ils contiennent. Toutefois, selon le manuel du groupe de travail sur les produits cosmétiques relatif aux produits limites, les substances qui restaurent, corrigent ou modifient des fonctions physiologiques en exerçant des activités pharmacologiques sont identifiées “en raison de leur présentation” (ainsi que les allégations décrites ci-dessus) ou “en raison de leur fonction”. Cette dernière est “évaluée en tenant compte de toutes les caractéristiques du produit, y compris l’absorption, la concentration, la voie d’administration, la fréquence d’application, le site d’application et le degré de pénétration”. Il devient donc évident qu’il faut comprendre comment les caractéristiques des peptides et des protéines s’entremêlent pour créer des profils toxicologiques permettant de déterminer si un ingrédient est un médicament ou un produit cosmétique.
Références
Choi, Y.L., Park, E.J., Kim, E., Na, D.H. et Shin, Y.H. (2014). Stabilité dermique et perméation cutanée in vitro de pentapeptides de collagène (KTTKS et palmitoyl-KTTKS). Biomol. Ther. 22, 321-327.
Agence européenne des médicaments (2011). Questions et réponses sur la “Note for guidance of photosafety testing”.
Gocke, E., Albertini, S., Brendler-Schwaab, S., Müller, L., Suter, W. et Würgler, F.E. (1999). Tests de génotoxicité des produits issus de la biotechnologie : Rapport d’un groupe de travail du GUM. Mutat. Res. – Rev. Mutat. Res. 436, 137-156.
Henry, B., Foti, C., et Alsante, K. (2009). Les données relatives à l’absorption de la lumière et à la photostabilité peuvent-elles être utilisées pour évaluer les risques de photosécurité d’une nouvelle molécule médicamenteuse chez les patients ? J. Photochem. Photobiol. B Biol. 96, 57-62.
Huby, R.D.J. (2000). Pourquoi certaines protéines sont-elles allergènes ? Toxicol. Sci. 55, 235-246.
Conférence internationale sur l’harmonisation (2011). Évaluation préclinique de la sécurité des produits pharmaceutiques issus de la biotechnologie.
Conférence internationale sur l’harmonisation (2013). Évaluation de la photosécurité des produits pharmaceutiques.
Roberts, D.W., Basketter, D., Kimber, I., White, J., McFadden, J. et White, I.R. (2012). Le métabisulfite de sodium en tant qu’allergène de contact – un exemple de mécanisme chimique rare de modification des protéines. Contact Dermatitis 66, 123-127. SCCS (2014). Avis sur les protéines de blé hydrolysées.
Cet article a été rédigé par le Dr Boris Krivoshiev, ancien toxicologue principal, lorsqu’il travaillait chez BIORIUS.


