Introduzione

Nella parte precedente è stato evidenziato che i peptidi e le proteine sono ingredienti cosmetici interessanti, soprattutto per le loro attività anti-invecchiamento. Esiste già una pletora di materie prime cosmetiche a base di peptidi sul mercato, e altre sono in continua ricerca.
Finora, la regolamentazione di questi ingredienti riguarda soprattutto la loro origine (devono essere sintetizzati o estratti, ma non da cellule umane e altri organismi) e le indicazioni di marketing. Nella maggior parte dei casi, queste affermazioni non sono frivole, ma sono bilanciate da un’attività fisiologica pronunciata, spesso accompagnata da effetti collaterali che devono essere indagati. In questa parte verranno discussi gli aspetti di sicurezza dei peptidi e delle proteine e alcune regole generalizzate per garantire un rischio limitato per la salute umana quando si sviluppano o si utilizzano nuovi peptidi e proteine nelle materie prime e nei prodotti cosmetici.
Ingredienti di nuova generazione contro quelli di generazione precedente
Data la loro potenziale bioattività, i peptidi e le proteine sono stati oggetto di un’intensa ricerca medica nel corso degli anni. Gli aspetti relativi alle loro proprietà e alla loro sicurezza possono quindi essere ricavati e confrontati con le piccole molecole chimicamente definite. Questo è analogo a quello dei cosmetici, dato che molti ingredienti utilizzati nel corso dei decenni sono piccole molecole chimicamente definite (niacinamide, retinolo, ecc.), rispetto alla nuova generazione di peptidi e proteine (fattori di crescita, subunità di collagene, ecc.).
Tabella 1: Confronto del profilo tra piccole molecole, peptidi e proteine
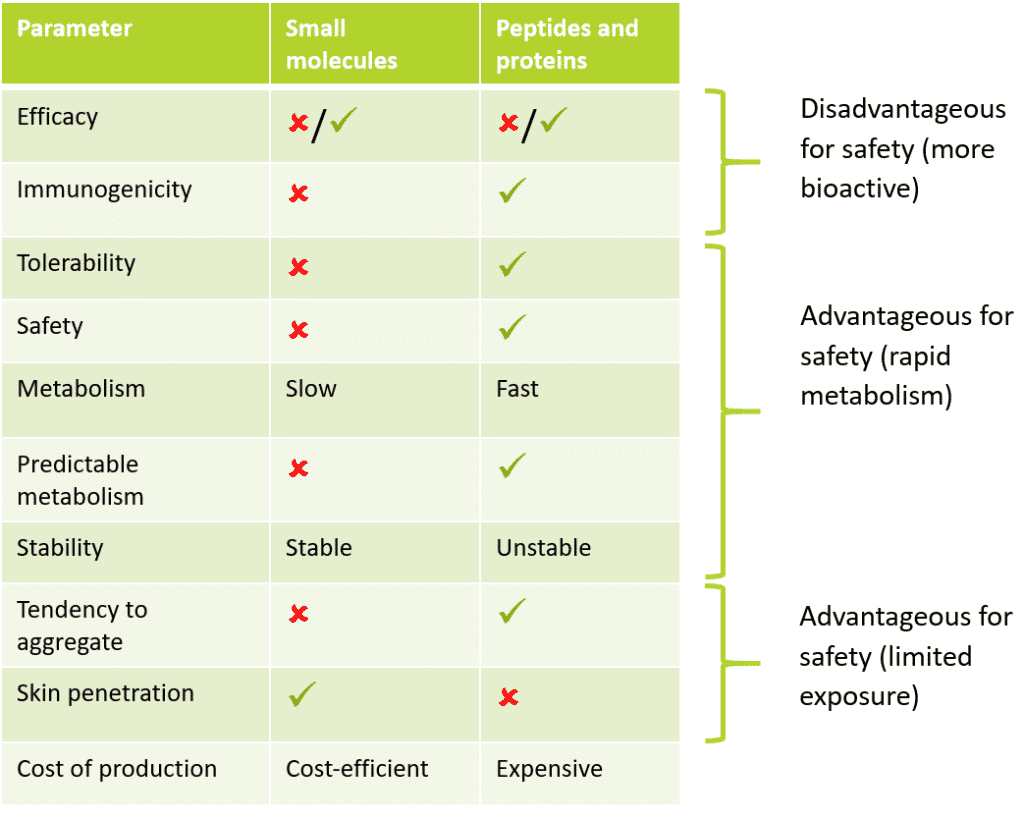
Come si può notare, i peptidi e le proteine hanno una serie di proprietà intrinseche che favoriscono un profilo di sicurezza migliore rispetto alle piccole molecole. Ad esempio, in base alla ricerca farmaceutica, i farmaci peptidici e proteici sono risultati più sicuri e meglio tollerati rispetto ai loro predecessori tradizionali a base di piccole molecole. Ciò è dovuto al rapido metabolismo e alla minore stabilità che determinano una minore biodisponibilità, pur mantenendo un minor numero di effetti fuori bersaglio.
In ambito cosmetico, questa minore biodisponibilità comporta una riduzione dei rischi per la sicurezza. Il fondamento di ciò è il dogma centrale della tossicologia: “la dose fa il veleno” – Paracelso del 1500, considerato il padrino della tossicologia. Le proprietà che conferiscono una minore tossicità ai peptidi e alle proteine rispetto alle piccole molecole saranno discusse di seguito per ogni endpoint tossicologico; molti di questi endpoint costituiscono la base della valutazione tossicologica di qualsiasi ingrediente.
Assorbimento, distribuzione, metabolismo ed escrezione

L’assorbimento, la distribuzione, il metabolismo e l’escrezione (o ADME) sono i processi principali che definiscono l’esposizione alle sostanze esogene. Se si considerano i cosmetici, ciò è dovuto principalmente all’assorbimento cutaneo, dato che i cosmetici vengono normalmente applicati per via cutanea e la pelle è una barriera importante per le sostanze esogene.
La pelle è composta da vari strati, il più alto dei quali è lo strato corneo, composto da cellule cheratinizzate strettamente impacchettate che fungono da barriera significativa all’ingresso di sostanze grandi e/o idrofile.
I peptidi hanno generalmente un peso molecolare da elevato a molto elevato e sono tipicamente carichi a pH fisiologico, il che li rende idrofili, contribuendo così alla loro scarsa permeazione cutanea passiva. Inoltre, i peptidi contengono legami amidici multipli (come gruppi donatori e accettatori di legami a idrogeno) che possono potenzialmente influenzare la loro diffusione attraverso la pelle.
Un altro aspetto che merita di essere considerato è il metabolismo e l’attività proteolitica della pelle, potenzialmente importanti per la somministrazione transcutanea dei peptidi. La pelle contiene sistemi enzimatici paragonabili a quelli presenti in altri tessuti, come ad esempio il fegato. Gli enzimi endogeni come le deaminasi, le esterasi e le aminopeptidasi si trovano in tutti i compartimenti della pelle e possono contribuire al rapido metabolismo di peptidi e proteine prima di entrare nella circolazione sistemica, supponendo che questi peptidi e proteine siano riusciti ad attraversare inizialmente lo strato corneo.
Per questo motivo, la pelle funge da barriera significativa per i peptidi e le proteine, grazie alle dimensioni di queste molecole e alla capacità metabolica della pelle, che porta a un’esposizione sistemica limitata. Un esempio che lo dimostra al meglio è forse quello del pentapeptide-4 (KTTKS) che, nonostante sia un peptide di soli 5 aminoacidi, è risultato non essere presente nel fluido recettoriale o in nessuno degli strati della pelle (strato corneo, epidermide e derma) nella pelle di topo senza peli (Choi et al., 2014).
Fototossicità

Il potenziale di fototossicità può essere identificato sulla base di parametri in silico. Ad esempio, il coefficiente di estinzione – la capacità di una sostanza di assorbire la luce – può essere utilizzato come indicazione del rischio potenziale. Ad esempio, le sostanze con coefficienti di estinzione inferiori a 1.000 L mol-1 cm-1 sono considerate meno rischiose dal punto di vista fototossico, poiché è improbabile che questo basso livello di assorbimento della luce risulti dannoso (Henry et al., 2009). Questa opinione è condivisa anche dall’IHC (International Conference on Harmonisation, 2013) e dall’Agenzia Europea del Farmaco (European Medicines Agency, 2011).
Per quanto riguarda i peptidi e le proteine, esistono diversi strumenti basati sul web in grado di prevedere i coefficienti di estinzione in base alla presenza di residui di tirosina, triptofano e cisteina, aminoacidi noti per assorbire la luce. Per questo motivo, limitare i residui di tirosina, triptofano e cisteina può limitare radicalmente il coefficiente di estinzione della proteina o del peptide e quindi limitare il rischio di fototossicità.
Genotossicità

In generale, non si ritiene che i peptidi e le proteine siano potenzialmente genotossici. In una delle sue linee guida (ICH S6(R1)), l’ICH (International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use) afferma che “Non si prevede che queste sostanze (peptidi/proteine) interagiscano direttamente con il DNA o altro materiale cromosomico” (International Conference on Harmonisation, 2011). Questo dato è stato ulteriormente confermato da altri studi in cui sono state testate 78 proteine per la genotossicità e solo quattro sembravano produrre effetti genotossici riproducibili.
L’attività di uno di questi peptidi è stata attribuita alla sua molecola legante, mentre non è stato possibile stabilire una chiara logica per i restanti 3 peptidi, se non una potenziale attività enzimatica/ormonale. Infatti, è stato concluso che per una proteina “media” è difficile prevedere reazioni elettrofile (Gocke et al., 1999).
Tuttavia, questo dimostra che è necessario prestare molta attenzione ai processi produttivi utilizzati per produrre questi peptidi e proteine, poiché alcuni reagenti possono essere genotossici, mentre le fasi di purificazione devono essere incorporate nei processi produttivi per limitare il passaggio di potenziali sottoprodotti alla materia prima.
Sensibilizzazione

Il tipo di sensibilizzazione più significativo per i prodotti cosmetici è la dermatite da contatto, che è classificata come sensibilizzazione di tipo 4 e coinvolge soprattutto le cellule T. È generalmente accettato che i sensibilizzatori cutanei siano elettrofili e in grado di reagire con i gruppi nucleofili delle proteine, come le unità di cisteina e lisina.
Un altro importante meccanismo si basa sulle reazioni dei radicali liberi (Roberts et al., 2012). Poiché entrambi i tipi di reazioni sono improbabili con il peptide in esame e poiché si prevede che l’assorbimento di tale composto sia basso, il rischio di sensibilizzazione cutanea è considerato basso.
Tuttavia, dato che molte proteine e peptidi presenti negli alimenti fungono anche da allergeni, le proteine e i peptidi utilizzati nei cosmetici meritavano di essere valutati per questo tipo di allergenicità. In particolare, l’ipersensibilità immediata, come l’allergia e l’anafilassi, coinvolge meccanismi diversi rispetto alla dermatite da contatto.
Nella sensibilizzazione di tipo 1, le cellule effettrici sono per lo più cellule che producono anticorpi, come i mastociti e gli anticorpi IgE. Tuttavia, dai pareri scientifici dell’SCCS e del CIR sulle proteine idrolizzate del grano, risulta chiaro che i peptidi con un peso molecolare inferiore a 3,5 kDa hanno una bassa capacità di sensibilizzazione (SCCS, 2014). Pertanto, affinché si verifichi una reazione di sensibilizzazione di tipo 1, un allergene deve legare due anticorpi IgE. Pertanto, un allergene deve contenere almeno due siti di legame per le IgE, ciascuno con una lunghezza minima di 15 aminoacidi. Ciò implica che la dimensione minima degli allergeni proteici è di circa 30 aminoacidi (Huby, 2000).
Potenziale pericolo per la salute umana

Sulla base di quanto discusso in precedenza, si potrebbe pensare che i peptidi e le proteine non abbiano profili tossicologici significativi, il che sarebbe errato. Infatti, i peptidi e le proteine possono comportare rischi per la salute umana, determinati dalla biodisponibilità e da una farmacologia esagerata. Ad esempio, le proteine sotto forma di recettori ed enzimi sono considerate l’unità funzionale che facilita le normali funzioni corporee. Lo stesso vale per i peptidi che includono molecole di segnalazione. Per questo motivo, se si verificasse uno squilibrio nell’omeostasi a causa dell’aumento o della diminuzione dell’attività, potrebbero verificarsi effetti negativi. Tuttavia, l’identificazione di questi eventi “farmacologici esagerati” non è facilmente individuabile negli attuali approcci ai test di sicurezza.
Per identificare i potenziali rischi per la salute umana e, data la natura delle proteine e dei peptidi, potrebbe verificarsi una cascata di eventi biologici che potrebbero portare a un effetto negativo, è necessario un approccio olistico. Per questo, si può pensare che le tecnologie omiche di nuova generazione possano essere di grande aiuto. In breve, queste tecnologie consentono di avere una panoramica completa degli eventi molecolari che si verificano a livello di geni e proteine. Una volta identificata una rete di geni e/o proteine interessate, questa può essere collegata alle modalità d’azione molecolari che si sa daranno luogo a effetti negativi sulla salute. Questo è in linea con l’approccio Adverse Outcomes Pathway (AOP), in cui gli effetti negativi apicali sulla salute sono previsti a partire da eventi molecolari iniziali, un approccio che sta guadagnando terreno nella tossicologia normativa. Un’implementazione di successo richiederebbe lo sviluppo di competenze in questi campi, garantendo al contempo che i test non siano proibitivi dal punto di vista dei costi. Inoltre, alcune AOP sono state sviluppate e convalidate, mentre altre sono in varie fasi di accettazione e sviluppo. In effetti, c’è ancora una notevole quantità di lavoro da fare per mappare i percorsi molecolari tossicologici come AOP. Per questo motivo, dato che i rischi per la salute umana non possono ancora essere facilmente identificati con questi approcci, l’incertezza viene gestita garantendo la limitata biodisponibilità di questi ingredienti cosmetici.
Conclusione

Come descritto in precedenza, i peptidi e le proteine godono di una serie di proprietà che potrebbero limitare i rischi per la salute. Queste proprietà sono particolarmente importanti alla luce del divieto di sperimentazione animale per gli ingredienti cosmetici. Tuttavia, per mantenere queste caratteristiche, è necessario evitare di apportare modifiche significative a questi ingredienti. Questi includono brevemente:
- Nessuna modifica estesa per aumentare in modo significativo l’assorbimento: questo serve a mantenere il dogma centrale della tossicologia: esposizione limitata = rischio limitato.
- Modifiche limitate agli aminoacidi: gli aminoacidi naturali non dovrebbero essere genotossici, cancerogeni o tossici per la riproduzione, pur essendo rapidamente metabolizzati.
- Limitare la quantità di residui di tirosina, triptofano e cisteina – limitare il potenziale di fototossicità
- Includere fasi di purificazione nei processi di produzione per limitare la presenza di impurità potenzialmente pericolose.
Queste considerazioni sono importanti alla luce del divieto di sperimentazione animale per gli ingredienti cosmetici, per cui i tossicologi devono affidarsi a dati e strumenti diversi dai tradizionali test tossicologici sugli animali. Inoltre, come menzionato nella Parte I, i cosmetici e i farmaci si distinguono in base all’uso che se ne intende fare, che si basa principalmente sulle loro indicazioni. Tuttavia, in base al manuale del Gruppo di Lavoro sui Prodotti Cosmetici sui prodotti borderline, le sostanze che ripristinano, correggono o modificano le funzioni fisiologiche esercitando attività farmacologiche sono identificate “in virtù della sua presentazione” (quindi le indicazioni descritte sopra), o “in virtù della sua funzione”. Quest’ultima viene “valutata considerando tutte le caratteristiche del prodotto, tra cui l’assorbimento, la concentrazione, la via di somministrazione, la frequenza di applicazione, il sito di applicazione e il grado di penetrazione”. Di conseguenza, diventa evidente il ruolo della comprensione di come le caratteristiche dei peptidi e delle proteine si intrecciano per determinare i profili tossicologici di un ingrediente come farmaco o cosmetico.
Riferimenti
Choi, Y.L., Park, E.J., Kim, E., Na, D.H. e Shin, Y.H. (2014). Stabilità cutanea e permeazione cutanea in vitro di pentapeptidi di collagene (KTTKS e palmitoyl-KTTKS). Biomol. Ther. 22, 321-327.
Agenzia Europea dei Medicinali (2011). Domande e risposte sulla “Nota di orientamento per i test di sicurezza fotografica”.
Gocke, E., Albertini, S., Brendler-Schwaab, S., Müller, L., Suter, W. e Würgler, F.E. (1999). Test di genotossicità dei prodotti derivati dalle biotecnologie: Relazione di una task force GUM. Mutat. Res. – Rev. Mutat. Res. 436, 137-156.
Henry, B., Foti, C. e Alsante, K. (2009). I dati sull’assorbimento della luce e sulla fotostabilità possono essere utilizzati per valutare i rischi di fotosicurezza nei pazienti per una nuova molecola di farmaco? J. Photochem. Photobiol. B Biol. 96, 57-62.
Huby, R.D.J. (2000). Perché alcune proteine sono allergeniche? Toxicol. Sci. 55, 235-246.
Conferenza internazionale sull’armonizzazione (2011). Valutazione preclinica della sicurezza dei farmaci derivati dalle biotecnologie.
Conferenza internazionale sull’armonizzazione (2013). Valutazione della fotosicurezza dei farmaci.
Roberts, D.W., Basketter, D., Kimber, I., White, J., McFadden, J. e White, I.R. (2012). Il metabisolfito di sodio come allergene da contatto: un esempio di un raro meccanismo chimico di modifica delle proteine. Dermatite da contatto 66, 123-127. SCCS (2014). Opinione sulle proteine idrolizzate del grano.
Questo articolo è stato scritto dal Dr. Boris Krivoshiev, ex Principal Toxicologist, durante il suo periodo di lavoro presso BIORIUS.


