La frontera entre un producto cosmético y un producto sanitario
Un cambio importante en el Reglamento de Productos Sanitarios (UE) 2017/745 (el MDR) es la integración de 6 grupos de productos en su ámbito de aplicación: los “Productos Cosméticos” enumerados en el Anexo XVI, que dice lo siguiente:
LISTA DE GRUPOS DE PRODUCTOS SIN FINALIDAD MÉDICA CONTEMPLADOS EN EL ARTÍCULO 1, APARTADO 2
- Lentes de contacto u otros objetos destinados a ser introducidos en o sobre el ojo.
- Productos destinados a ser introducidos total o parcialmente en el cuerpo humano por medios quirúrgicamente invasivos con el fin de modificar la anatomía o la fijación de partes del cuerpo, con excepción de los productos de tatuaje y los piercings.
- Sustancias, combinaciones de sustancias o artículos destinados a ser utilizados para el relleno facial o de otras membranas dérmicas o mucosas mediante inyección subcutánea, submucosa o intradérmica u otro tipo de introducción, excluidos los destinados al tatuaje.
- Aparatos destinados a reducir, eliminar o destruir tejido adiposo, como los aparatos de liposucción, lipólisis o lipoplastia.
- Aparatos emisores de radiaciones electromagnéticas de alta intensidad (por ejemplo, infrarrojos, luz visible y ultravioleta) destinados a ser utilizados sobre el cuerpo humano, incluidas las fuentes coherentes y no coherentes, monocromáticas y de amplio espectro, como los láseres y los aparatos de luz pulsada intensa, para el rejuvenecimiento de la piel, la eliminación de tatuajes o del vello u otros tratamientos cutáneos.
- Equipos destinados a la estimulación cerebral que aplican corrientes eléctricas o campos magnéticos o electromagnéticos que penetran en el cráneo para modificar la actividad neuronal del cerebro.
Aunque algunos de los productos enumerados son fáciles de identificar, como las lentes de contacto “decorativas”, la verborrea utilizada dificulta en cierto modo la comprensión de los aparatos de que se trata. Primero intentaremos aclarar este punto.
LOS GRUPOS DE PRODUCTOS SIN FINALIDAD MÉDICA CONTEMPLADOS EN EL ARTÍCULO 1, APARTADO 2
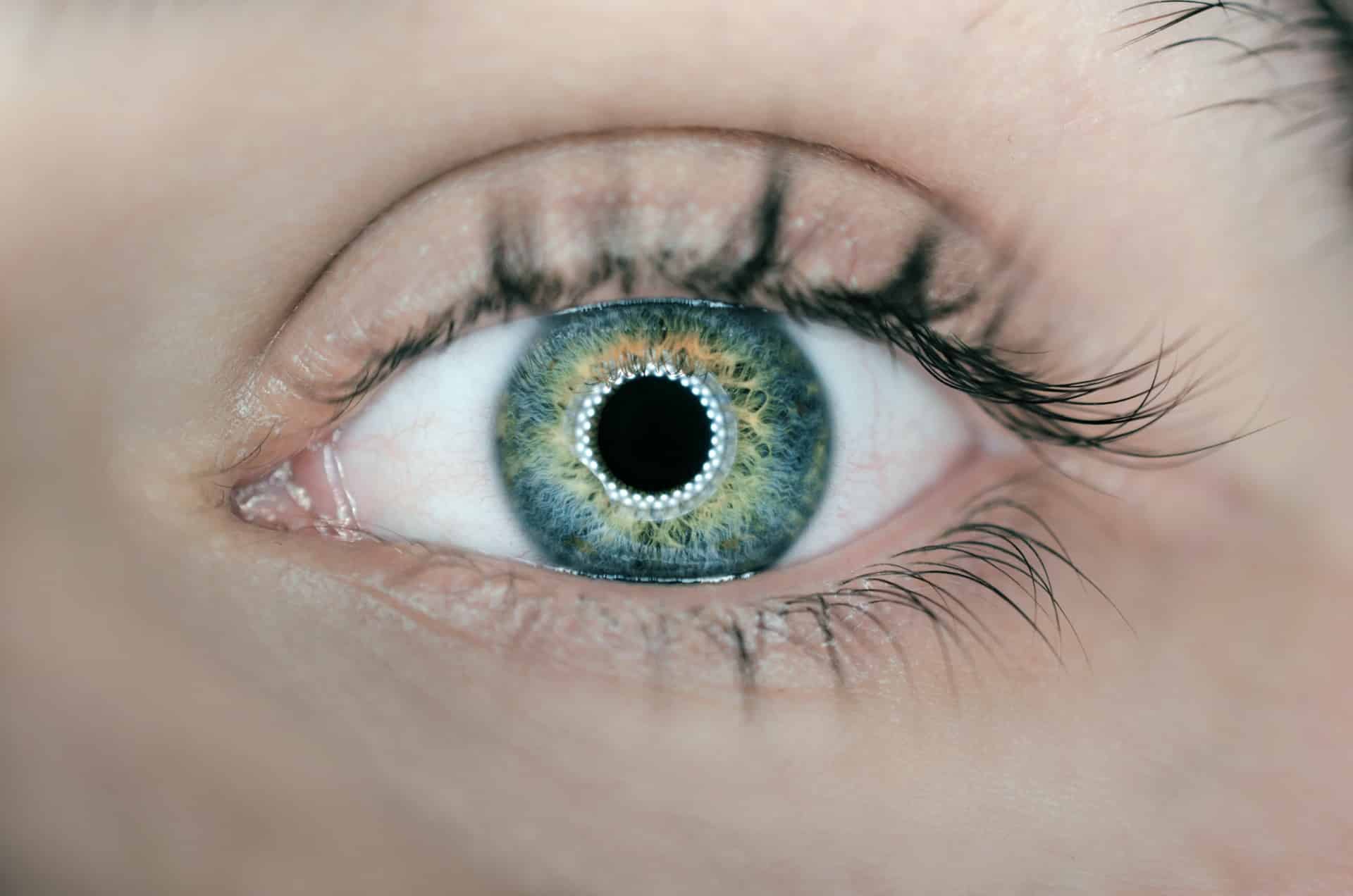
Lentes de contacto u otros objetos destinados a ser introducidos en o sobre el ojo.
Estos dispositivos son lentes “decorativas” para cambiar el color de tus ojos, por ejemplo de marrón a azul, o perforaciones en el globo ocular, como se muestra en la imagen.
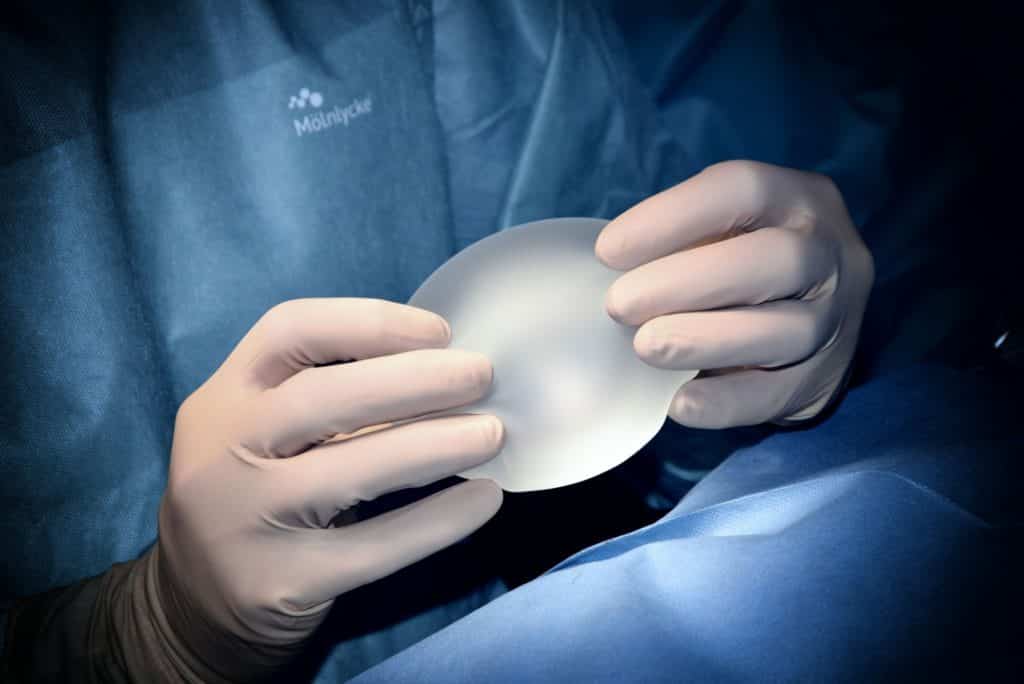
Productos destinados a ser introducidos total o parcialmente en el cuerpo humano por medios quirúrgicos invasivos con el fin de modificar la anatomía o fijar partes del cuerpo, a excepción de los productos para tatuajes y los piercings..
Se trata de implantes mamarios utilizados para el aumento de mamas femeninas, pero también todo tipo de implantes masculinos para bíceps, pantorrillas o pectorales, además de otros implantes en la cara para modificar el aspecto.
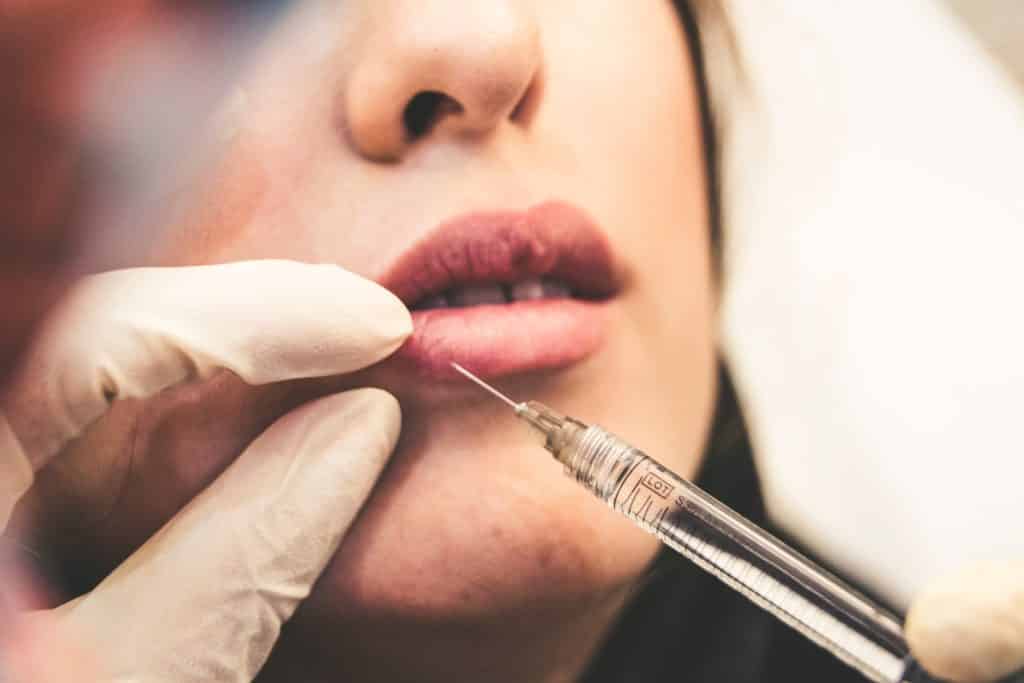
Sustancias, combinaciones de sustancias o artículos destinados a ser utilizados para el relleno facial o de otras membranas dérmicas o mucosas mediante inyección subcutánea, submucosa o intradérmica u otro tipo de introducción, excluidos los destinados al tatuaje.
Estos dispositivos se conocen como “rellenos dérmicos” y son implantes inyectables que se suelen utilizar en las clínicas estéticas para eliminar arrugas, rellenar los labios y otras zonas de la cara, pero también se pueden utilizar en la zona genital. Un ingrediente famoso es el Ácido Hialurónico. Pero, ¿qué significan esas sustancias destinadas a la cara y la dermis por “otra introducción”? ¿Los productos de mesoterapia son los productos objetivo? Si es así, queda mucho por hacer en esta práctica.
Aparatos destinados a reducir, eliminar o destruir tejido adiposo, como los aparatos de liposucción, lipólisis o lipoplastia
Se trata de aparatos utilizados para la liposucción, pero también los que utilizan criotermia u otras técnicas.
Aparatos emisores de radiaciones electromagnéticas de alta intensidad (por ejemplo, infrarrojos, luz visible y ultravioleta) destinados a ser utilizados sobre el cuerpo humano, incluidas las fuentes coherentes y no coherentes, monocromáticas y de amplio espectro, como los láseres y los aparatos de luz pulsada intensa, para el rejuvenecimiento de la piel, la eliminación de tatuajes o del vello u otros tratamientos cutáneos.
Estos aparatos utilizan la luz para actuar sobre el vello o la piel. Una de las dificultades a este respecto es la falta de una definición detallada de estos dispositivos, por ejemplo, ¿cuál es el nivel de radiación luminosa que debe considerarse de alta intensidad?

Equipos destinados a la estimulación cerebral que aplican corrientes eléctricas o campos magnéticos o electromagnéticos que penetran en el cráneo para modificar la actividad neuronal del cerebro.

Estos dispositivos están destinados a tratar la depresión, aliviar el dolor o, sin ningún fin médico, estimular la capacidad cerebral. Para ello pueden utilizar corriente eléctrica, campos magnéticos o electromagnéticos.
¿Con fines estéticos o médicos? ¿Qué dice el nuevo Reglamento?
De hecho, algunos de estos productos sin fines médicos pueden tener habitualmente el marcado CE y sus fabricantes ya están familiarizados con las evaluaciones de conformidad de los Organismos Notificados. Lo mismo ocurre con los implantes mamarios, los rellenos dérmicos y los equipos de luz pulsada. Para estos dispositivos, existen aplicaciones con fines médicos y aplicaciones no médicas. La aclaración aportada por el anexo XVI era necesaria porque las Directivas se aplicaban de forma diferente en algunos países de la UE y los productos considerados como Productos Sanitarios no pertenecían a esta categoría en otros países. La aplicación uniforme del nuevo Reglamento en todos los Estados miembros de la UE hace que las mismas normas sean aplicables en toda la Unión Europea.
Además, este cambio pondrá fin a la conocida hipocresía que empuja a los fabricantes a tergiversar sus fines pretendiendo que había una indicación médica cuando la mayoría de sus dispositivos tenían fines puramente estéticos. Por ejemplo, los implantes mamarios estaban indicados para la reconstrucción mamaria tras una mastectomía por cáncer, pero muchos de ellos se vendieron para el aumento mamario. Los fabricantes de rellenos dérmicos tenían que encontrar pacientes con enfermedades muy específicas cuando sus dispositivos se utilizaban principalmente para mujeres de un rango de edad concreto. Los fabricantes ya no tendrán que presentar los beneficios clínicos y podrán limitar su demostración a la seguridad clínica.
En el caso de las lentes de contacto decorativas, es otra historia, ya que a sus fabricantes no les afectaba antes la normativa sobre productos sanitarios. Tendrán que demostrar la seguridad de su dispositivo, implantar un Sistema de Gestión de la Calidad y cambiar radicalmente su documentación. De hecho, tendrán que cumplir la normativa del mismo modo que los fabricantes de lentes de contacto correctoras, excluyendo la demostración del beneficio clínico, que se limitará a la parte de seguridad. Las normas aplicables a cada grupo de dispositivos serán las existentes para tecnologías similares: por ejemplo, las normas relativas a las lentes de contacto correctoras serán aplicables a las lentes de contacto decorativas.
¿Cuándo serán aplicables estas nuevas normas?
El plan original era publicar las Especificaciones Comunes antes del 26 de mayo de 2021, fecha de aplicación del Reglamento, y dar un plazo de 6 meses a los fabricantes para que estuvieran conformes. Pero hasta la fecha (diciembre de 2021), no se ha publicado ninguna Especificación Común sobre este tema y, con la falta de recursos de los organismos notificados, puede que no sea un asunto de alta prioridad para la Comisión Europea.
¿Es una opción “esperar y ver”? Probablemente no, ya que prepararse para este Reglamento puede llevar de 12 a 36 meses, dependiendo del punto de partida, de los recursos que puedas dedicarle y de la disponibilidad del organismo notificado elegido. El plazo de 6 meses previsto en el reglamento para prepararlo se ha subestimado en gran medida.
Por tanto, es hora de ponerse en contacto con Biorius para preparar tus productos y tu empresa para este importantecambio normativo.