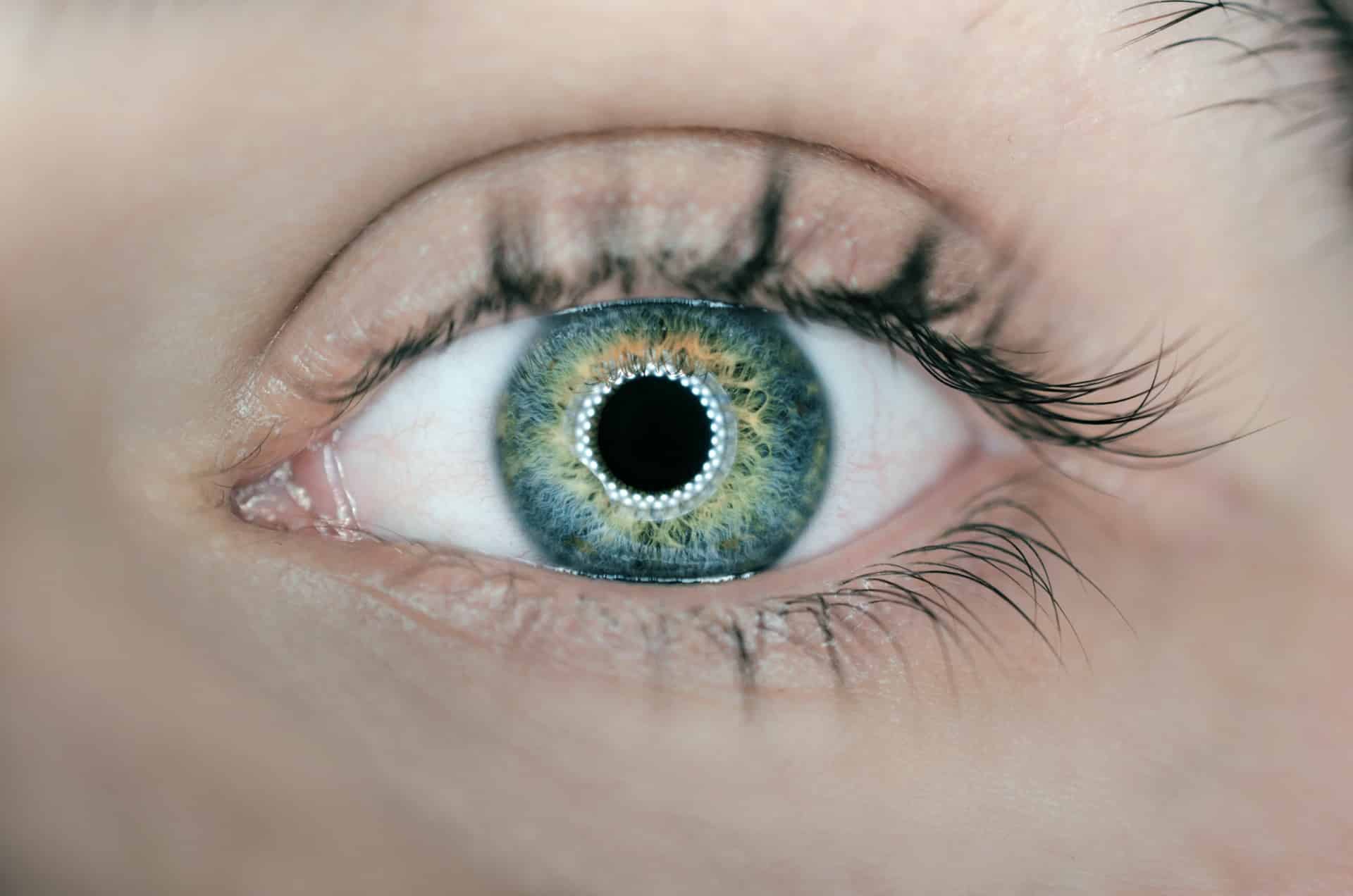
Il confine tra un prodotto cosmetico e un dispositivo medico
Un importante cambiamento nel Regolamento sui Dispositivi Medici (UE) 2017/745 (MDR) è l’integrazione di 6 gruppi di prodotti nel suo campo di applicazione: i “Prodotti Cosmetici” elencati nell’Allegato XVI che recita quanto segue:
ELENCO DEI GRUPPI DI PRODOTTI PRIVI DI FINALITÀ MEDICHE DI CUI ALL’ARTICOLO 1, PARAGRAFO 2
- Lenti a contatto o altri oggetti destinati a essere introdotti o applicati all’occhio.
- Prodotti destinati a essere introdotti totalmente o parzialmente nel corpo umano attraverso mezzi chirurgici invasivi allo scopo di modificare l’anatomia o fissare parti del corpo, ad eccezione dei prodotti per tatuaggi e piercing.
- Sostanze, combinazioni di sostanze o articoli destinati a essere utilizzati per il riempimento del viso o di altre membrane dermiche o mucose mediante iniezione sottocutanea, sottomucosa o intradermica o altra introduzione, esclusi quelli per il tatuaggio.
- Apparecchiature destinate a essere utilizzate per ridurre, rimuovere o distruggere il tessuto adiposo, come le apparecchiature per la liposuzione, la lipolisi o la lipoplastica.
- Apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità (ad esempio infrarossi, luce visibile e ultravioletti) destinate all’uso sul corpo umano, comprese le sorgenti coerenti e non coerenti, monocromatiche e ad ampio spettro, come i laser e le apparecchiature a luce pulsata intensa, per il resurfacing della pelle, la rimozione di tatuaggi o peli o altri trattamenti cutanei.
- Apparecchiature destinate alla stimolazione cerebrale che applicano correnti elettriche o campi magnetici o elettromagnetici che penetrano nel cranio per modificare l’attività neuronale del cervello.
Mentre alcuni prodotti elencati sono facili da identificare, come le lenti a contatto “decorative”, la terminologia utilizzata rende in qualche modo difficile capire quali siano i dispositivi interessati. Cerchiamo innanzitutto di chiarire questo punto.
I GRUPPI DI PRODOTTI PRIVI DI FINALITÀ MEDICHE DI CUI ALL’ARTICOLO 1, PARAGRAFO 2
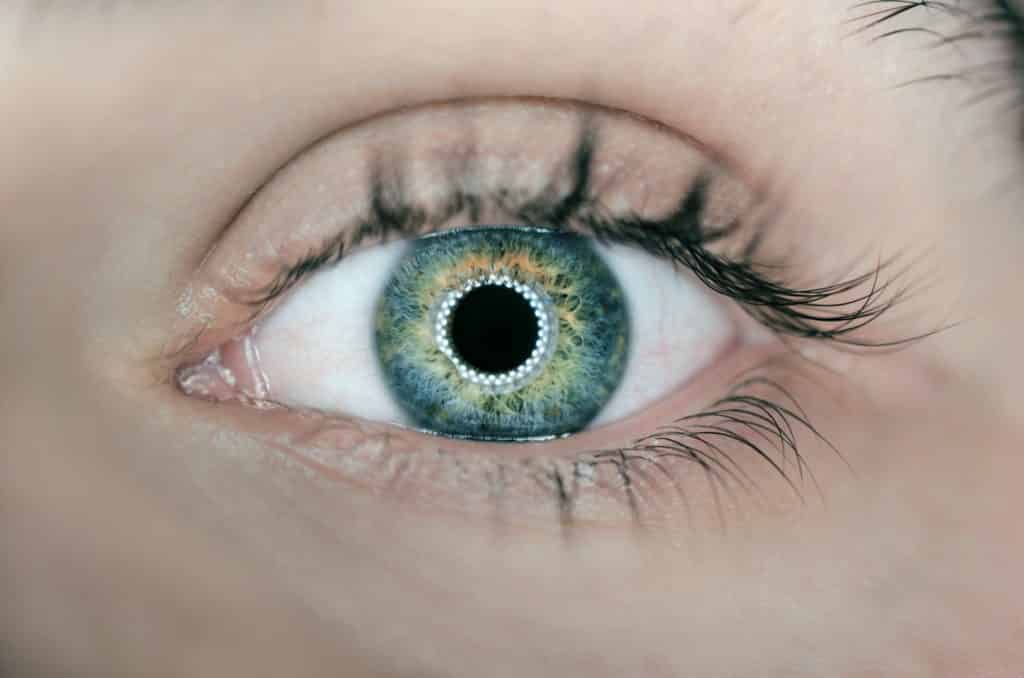
Lenti a contatto o altri oggetti destinati a essere introdotti o applicati all’occhio.
Questi dispositivi sono lenti “decorative” per cambiare il colore dei tuoi occhi, ad esempio da marrone a blu, oppure piercing al bulbo oculare come mostrato nell’immagine.
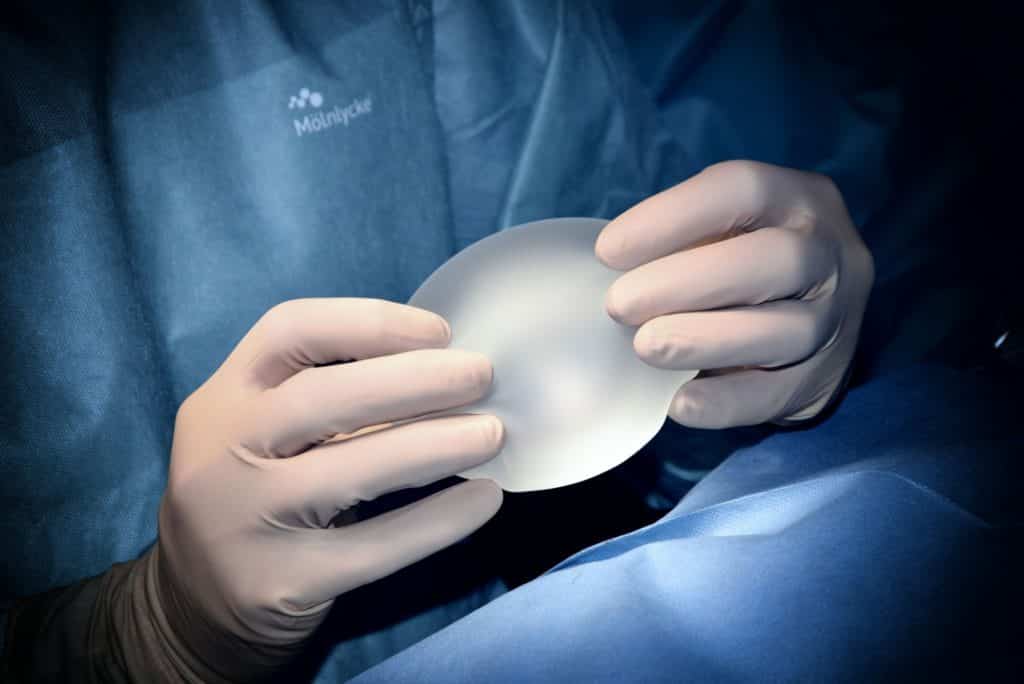
Prodotti destinati ad essere introdotti totalmente o parzialmente nel corpo umano attraverso mezzi chirurgici invasivi allo scopo di modificare l’anatomia o fissare parti del corpo, ad eccezione dei prodotti per tatuaggi e piercing..
Si tratta di protesi mammarie utilizzate per l’aumento del seno femminile, ma anche di tutti i tipi di protesi maschili per bicipiti, polpacci o pettorali, oltre ad altre protesi sul viso per modificarne l’aspetto.
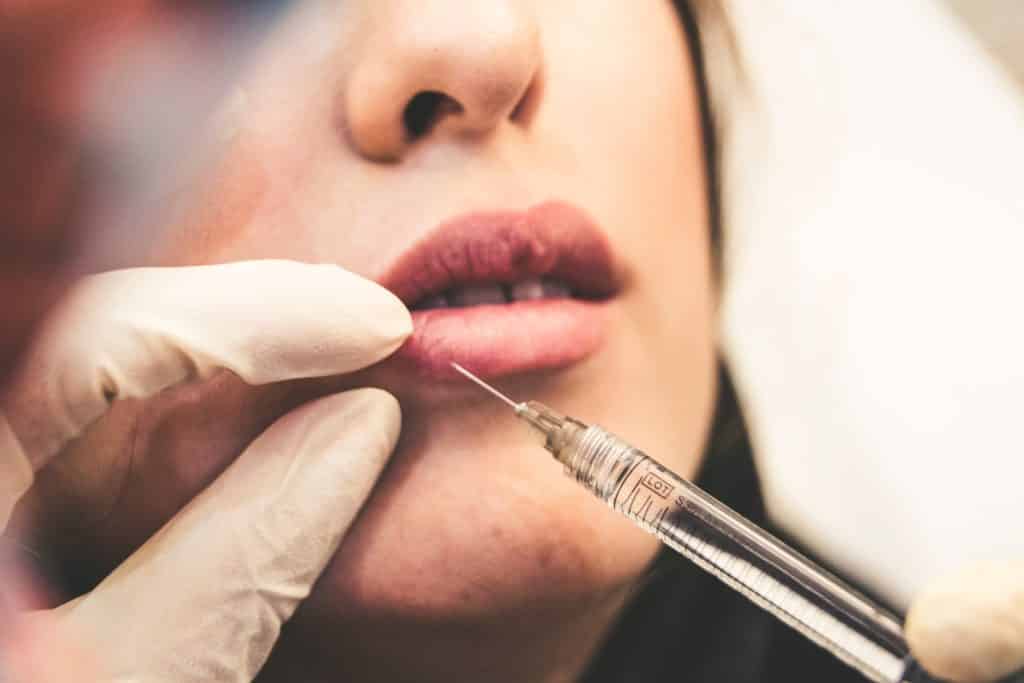
Sostanze, combinazioni di sostanze o articoli destinati a essere utilizzati per il riempimento del viso o di altre membrane dermiche o mucose mediante iniezione sottocutanea, sottomucosa o intradermica o altra introduzione, esclusi quelli per il tatuaggio.
Questi dispositivi sono noti come “filler dermici” e sono impianti iniettabili comunemente utilizzati nelle cliniche estetiche per eliminare le rughe, rimpolpare le labbra e altre aree del viso, ma possono essere utilizzati anche nell’area genitale. Un ingrediente famoso è l’Acido Ialuronico. Ma quali sono le sostanze destinate al viso e al derma con “altra introduzione”? I prodotti per mesoterapia sono i prodotti mirati? Se è così, c’è molto da fare in questa pratica.
Apparecchiature destinate a essere utilizzate per ridurre, rimuovere o distruggere il tessuto adiposo, come le apparecchiature per la liposuzione, la lipolisi o la lipoplastica
Si tratta di dispositivi utilizzati per la liposuzione ma anche di quelli che utilizzano la criotermia o altre tecniche.
Apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità (ad esempio infrarossi, luce visibile e ultravioletti) destinate all’uso sul corpo umano, comprese le sorgenti coerenti e non coerenti, monocromatiche e ad ampio spettro, come i laser e le apparecchiature a luce pulsata intensa, per il resurfacing della pelle, la rimozione di tatuaggi o peli o altri trattamenti cutanei.
Questi dispositivi utilizzano la luce per agire sui peli o sulla pelle. Una delle difficoltà è la mancanza di una definizione dettagliata per questi dispositivi, ad esempio qual è il livello di radiazione luminosa da considerare ad alta intensità?

Apparecchiature destinate alla stimolazione cerebrale che applicano correnti elettriche o campi magnetici o elettromagnetici che penetrano nel cranio per modificare l’attività neuronale del cervello.

Questi dispositivi sono destinati a trattare la depressione, ad alleviare il dolore o a stimolare le capacità cerebrali senza alcuno scopo medico. Per farlo, possono utilizzare corrente elettrica, campi magnetici o elettromagnetici.
Finalità estetiche o mediche? Cosa dice il nuovo regolamento?
Infatti, alcuni di questi dispositivi senza finalità mediche possono essere comunemente marcati CE e i loro produttori hanno già familiarità con le valutazioni di conformità degli organismi notificati. Lo stesso vale per le protesi mammarie, i filler dermici e le apparecchiature IPL. Per questi dispositivi esistono sia applicazioni mediche che non mediche. Il chiarimento apportato dall’allegato XVI era necessario perché le direttive erano applicate in modo diverso in alcuni paesi dell’UE e i dispositivi considerati dispositivi medici non rientravano in questa categoria in altri paesi. L’applicazione uniforme del nuovo regolamento per tutti gli Stati membri dell’UE rende le stesse regole applicabili ovunque nell’Unione Europea.
Inoltre, questo cambiamento porrà fine alla ben nota ipocrisia che spinge i produttori a distorcere gli scopi previsti, fingendo che vi sia un’indicazione medica quando la maggior parte dei loro dispositivi ha scopi puramente estetici. Ad esempio, le protesi mammarie erano indicate per la ricostruzione del seno dopo una mastectomia dovuta a un tumore, ma molte di esse sono state vendute per l’aumento del seno. I produttori di filler dermici hanno dovuto trovare pazienti con patologie molto specifiche quando i loro dispositivi venivano utilizzati principalmente per le donne in una determinata fascia d’età. I produttori non dovranno più presentare i benefici clinici e potranno limitare la loro dimostrazione alla sicurezza clinica.
Per quanto riguarda le lenti a contatto decorative, è un’altra storia, dato che i loro produttori non erano precedentemente interessati dalle normative sui dispositivi medici. Dovranno dimostrare la sicurezza del loro dispositivo, implementare un Sistema di Gestione della Qualità e modificare drasticamente la loro documentazione. Infatti, dovranno rispettare il regolamento allo stesso modo dei produttori di lenti a contatto correttive, ad esclusione della dimostrazione dei benefici clinici che sarà limitata alla parte relativa alla sicurezza. Gli standard applicabili a ciascun gruppo di dispositivi saranno quelli esistenti per tecnologie simili: ad esempio, gli standard relativi alle lenti a contatto correttive saranno applicabili alle lenti a contatto decorative.
Quando saranno applicabili queste nuove regole?
Il piano originale prevedeva di pubblicare le Specifiche Comuni prima del 26 maggio 2021, data di applicazione del regolamento, e di concedere ai produttori un termine di 6 mesi per conformarsi. Tuttavia, ad oggi (dicembre 2021), non sono state pubblicate specifiche comuni su questo argomento e, data la mancanza di risorse per gli organismi notificati, potrebbe non essere una questione prioritaria per la Commissione Europea.
Aspettare e vedere è un’opzione? Probabilmente no, perché prepararsi a questo regolamento potrebbe richiedere dai 12 ai 36 mesi, a seconda del punto di partenza, delle risorse che puoi impiegare e della disponibilità dell’organismo notificato scelto. Il periodo di 6 mesi previsto dal regolamento per prepararsi è stato ampiamente sottovalutato.
È quindi giunto il momento di contattare Biorius per preparare i tuoi prodotti e la tua azienda a questo importantecambiamento normativo.