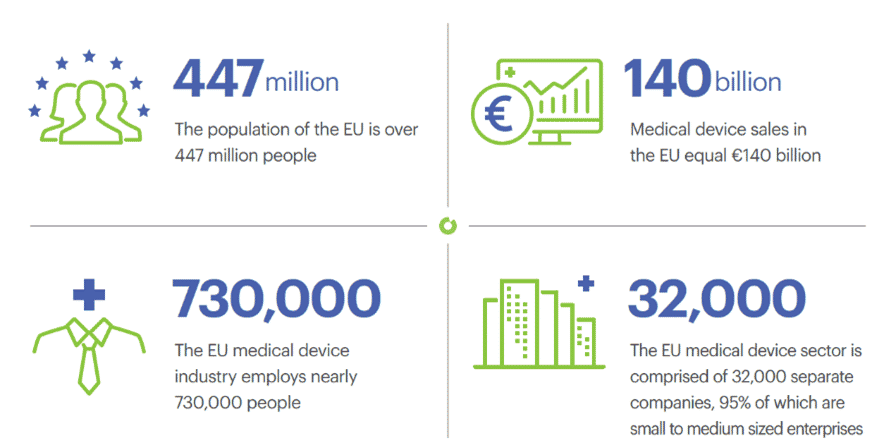
Medizinische Geräte sind in Europa ein sehr komplexer Bereich, in dem Milliardengewinne erzielt werden. Es gibt zahlreiche Arten und Kategorien, und ihre Verwendung ist immer mit hohen Risiken für die menschliche Sicherheit verbunden. All diese Faktoren machen die Rahmenbedingungen für Medizinprodukte verwirrend, zumal sie sich ständig weiterentwickeln. Die EU ist derzeit dabei, ihre Vorschriften für Medizinprodukte grundlegend zu ändern, und die Markenhersteller sollten ernsthaft darauf achten, welche Auswirkungen dies in den nächsten Jahren auf ihre Tätigkeit haben wird.
Auf der anderen Seite gewinnen Beauty-Tools immer mehr Interesse bei den europäischen Verbrauchern, die gerne die neueste Technologie auf dem Markt ausprobieren möchten. Schönheitsmittel können als Medizinprodukte, Medizinprodukte ohne medizinische Zweckbestimmung oder Allzweckprodukte kategorisiert werden, so dass ihre Kategorisierung ein erster Schritt in ihrem Vermarktungs- und Entwicklungsprozess ist. Wenn es sich bei Ihrem Schönheitsmittel um ein Medizinprodukt mit oder ohne medizinische Zweckbestimmung handelt, unterliegt es einer Reihe komplexer Vorschriften, die einen langen Prozess erfordern, bevor es verkauft werden darf. Lassen Sie uns in dieses faszinierende Thema eintauchen, das selbst für Profis auf diesem Gebiet kompliziert bleibt! Mit seinen Experten für Medizinprodukte ist BIORIUS immer über die neuesten Entwicklungen in Europa informiert.
Schönheitsmittel: Woher weiß man, ob sie in der EU als Medizinprodukte gelten?
Auch wenn die Kategorisierung von Beauty-Tools auf den ersten Blick eine einfache Aufgabe zu sein scheint, tun sich viele Marken mit dieser wichtigen Frage schwer.
Gemäß den EU-Standards muss ein Das Medizinprodukt sollte sich auf ein medizinisches Problem oder eine Krankheit beziehen, die dank der Wirkung des Produkts geheilt, behandelt oder diagnostiziert werden kann. Die Wirkungsweise muss physikalisch sein, denn Sie sollten nicht die Verwechslung zwischen einem Medizinprodukt und einem Medikament vornehmen. Während seine Hilfsfunktion medizinisch oder metabolisch sein kann (z.B. die Verteilung eines Medikaments im Körper), kann sein Hauptzweck nicht sein.
Die erste Frage, die Sie sich stellen sollten, um Ihr Schönheitsmittel zu kategorisieren, lautet daher: Weist mein Produkt eine medizinische Behauptung auf und bekämpft es das Problem physisch?
- Beispiel für ein Schönheitsmittel, das als Medizinprodukt eingestuft wird: LED-Lichtmaske zur Vorbeugung von schwerer Akne oder Rosacea.
- Beispiel für ein Schönheitsgerät, das als Allzweckprodukt kategorisiert ist: Microcurrent Gesichtsroller
ACHTUNG: Die Definition von Medizinprodukten ist nicht überall auf der Welt gleich. China, die USA und andere Länder haben unterschiedliche Standards. In den USA beispielsweise werden Mikrostrom-Gesichtsroller als Medizinprodukte eingestuft (Produktcode OUH).
EU-Medizinprodukteverordnung und Medizinprodukte ohne medizinische Zweckbestimmung
Die neuen EU-Vorschriften für Medizinprodukte
Innerhalb der Europäischen Union werden Medizinprodukte in zwei verschiedene Kategorien eingeteilt: “normale” Medizinprodukte (MDR) und In-Vitro-Diagnostika (IVDR). Ihr rechtlicher Rahmen wurde 2017 drastisch geändert, als zwei neue Verordnungen verabschiedet wurden: die Verordnung (EU) 2017/745 für MDR und die Verordnung (EU) 2017/746 für IVDR. Ziel war es, sich an die aktuellen technologischen Veränderungen anzupassen, die Regeln zu stärken, jegliche Interpretation zu vermeiden und die Praktiken zwischen der EU und den internationalen Ländern zu harmonisieren.
Was ist mit Großbritannien? Sie sind im Vereinigten Königreich als vorübergehende Maßnahme anwendbar. Die britischen Behörden entscheiden derzeit über eine spezifische Verordnung, die die EU-Verordnung ersetzen soll, während eine andere Kennzeichnung ab Juli 2023 vorgeschrieben sein wird (UKCA).
Schönheitsmittel und Kosmetika, die als Medizinprodukte eingestuft sind, gelten als MDR, aber es werden weitere Unterscheidungen zwischen ihnen getroffen. MDR werden in der Tat in Klasse I, Klasse IIa, Klasse IIb und Klasse III eingeteilt, von geringem bis hohem Risiko. Jede Klassifizierung ist mit spezifischen Anforderungen verbunden, wie z. B. den Pflichten des Herstellers, der Verpflichtung zur Benennung einer benannten Stelle oder einer zusätzlichen Registrierung in einigen EU-Mitgliedstaaten.
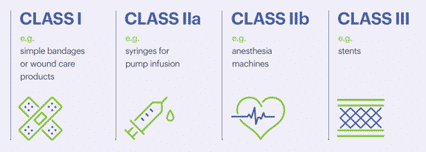
Ihre Schönheitsmittel oder Kosmetika können von Klasse I bis Klasse III eingestuft werden, der am stärksten regulierten und zeitaufwändigsten Klasse. Wenn Sie Unterstützung bei der Definition der Klassifizierung Ihres Produkts wünschen, ist BIORIUS für Sie da.
Daher müssen die Marken die spezifischen Anforderungen der Klasse sowie die neuen Vorschriften berücksichtigen, die vor kurzem in Kraft getreten sind und eine Anpassungsfrist bis 2025 vorsehen. Der berüchtigte Anhang XVI der Verordnung (EU) 2017/745 ist jedoch noch nicht umgesetzt, wird aber das Gesicht des europäischen Marktes für die betroffenen Hersteller drastisch verändern…
Medizinprodukte ohne medizinische Zweckbestimmung
Zusätzlich zu der oben genannten Definition kann ein Medizinprodukt keine medizinische Zweckbestimmung haben. Zu dieser Grenzkategorie gehören Kosmetika und Schönheitsmittel, die zunächst eine ästhetische Wirkung oder einen als ästhetisch “versteckten” medizinischen Zweck aufweisen. Aus Sicherheitsgründen wurden 6 Produktgruppen in den Anhang XVI der Verordnung (EU) 2017/745 aufgenommen, die als Medizinprodukte ohne medizinische Zweckbestimmung zu betrachten sind. Jede Einstufung unterliegt besonderen Anforderungen. Dieser Anhang XVI ist noch nicht offiziell veröffentlicht, da die spezifischen Anforderungen (Gemeinsame Spezifikationen) noch fehlen, aber es wird angenommen, dass er vor Ende 2022 veröffentlicht wird.
Wir haben bereits einen Artikel zu diesem Thema geschrieben, aber zur Erinnerung hier die 6 Produkte, auf die dieser Anhang abzielt:
- Kontaktlinsen oder andere Gegenstände, die in oder auf das Auge eingeführt werden.
- Produkte, die dazu bestimmt sind, ganz oder teilweise durch chirurgische Eingriffe in den menschlichen Körper eingeführt zu werden, um die Anatomie zu verändern oder Körperteile zu fixieren, mit Ausnahme von Tätowierungsprodukten und Piercings –> Implantate…
- Stoffe, Stoffkombinationen oder Gegenstände, die dazu bestimmt sind, durch subkutane, submuköse oder intradermale Injektion oder auf andere Weise in das Gesicht oder in andere Haut- oder Schleimhautbereiche eingebracht zu werden, mit Ausnahme derjenigen, die zum Tätowieren verwendet werden –> Dermal Filler, Micro Needling und Mesotherapiegeräte.
- Geräte, die dazu bestimmt sind, Fettgewebe zu reduzieren, zu entfernen oder zu zerstören, wie z.B. Geräte zur Fettabsaugung, Lipolyse oder Lipoplastie.
- Geräte, die hochintensive elektromagnetische Strahlung emittieren und zur Anwendung am menschlichen Körper bestimmt sind, einschließlich kohärenter und nicht-kohärenter Quellen, monochromatisch und mit breitem Spektrum, wie z.B. Laser und Geräte mit intensivem gepulstem Licht, für die Hauterneuerung, die Entfernung von Tätowierungen oder Haaren oder andere Hautbehandlungen–> LED-Haarentfernungsgeräte.
- Geräte zur Hirnstimulation, die elektrische Ströme oder magnetische oder elektromagnetische Felder anwenden, die in den Schädel eindringen, um die neuronale Aktivität des Gehirns zu verändern –> Behandlung von Depressionen…

ACHTUNG: Weitere Produktkategorien, die ein Risiko darstellen können, könnten in den Anhang XVI aufgenommen werden. Wenn Ihr Kosmetik- oder Schönheitsmittel in Anhang XVI aufgeführt ist oder wenn Sie glauben, dass es in Zukunft darin aufgenommen werden könnte, sollten Sie sich jetzt darauf vorbereiten, die Vorschriften einzuhalten.
Wenn ich Kosmetika oder Schönheitsmittel verkaufe, die als Medizinprodukte gelten, habe ich dann Zeit, die neuen EU-Verordnungen und den Anhang XVI einzuhalten?
Die Antwort ist ja, dank der Übergangsfristen. Sie wurden eingeführt, um Ihnen ausreichend Zeit einzuräumen, in der Sie sich entscheiden sollten, fortzufahren und mit der Durchführung der erforderlichen Studien zu beginnen und alle notwendigen Änderungen vorzunehmen. Dennoch sollten Sie sich darüber im Klaren sein, dass:
- Alle Marken und Hersteller haben bis 2024 Zeit, bevor ihr Zertifikat, das unter der alten Medizinprodukteverordnung erteilt wurde, seine Gültigkeit verliert. Tausende von Unternehmen bemühen sich bereits um die Einhaltung der Verordnung (EU) 2017/745 und Tausende weitere werden bis zur letzten Minute warten, um dies zu tun. Eine längere Bearbeitungszeit, die im Durchschnitt bereits 18 Monate beträgt, ist zu erwarten.
- Auch die Hersteller von Kosmetika und Schönheitsmitteln müssen sich an den Anhang XVI halten, sobald dieser umgesetzt ist, aber derzeit gibt es noch Unsicherheiten. Wenn Sie also wie Tausende andere Unternehmen bis zum letzten Moment warten, könnten lange Prozesszeiten Sie daran hindern, Ihr Produkt innerhalb der ursprünglich geplanten Frist auf den Markt zu bringen.
Diese beiden Faktoren zusammengenommen, kann es bis zu mehreren Jahren dauern, bis Sie von Ihrer benannten Stelle (falls Sie eine solche benötigen) zugelassen werden. Zusätzlich zu den überlasteten Benannten Stellen und der erwarteten Eile haben Medizinprodukte ohne medizinische Zweckbestimmung keine Priorität. Reguläre Medizinprodukte, die für die Sicherheit von Menschen oder die Gesundheitsfürsorge unerlässlich sind, werden zuerst behandelt, während die anderen möglicherweise als letztes an der Reihe sind.

Warten Sie nicht! BIORIUS kann Ihnen bei der Entwicklung Ihres Arzneimittels helfen, indem wir Ihnen die Dienstleistungen EU/UK Verantwortlicher (für Unternehmen mit Sitz außerhalb Europas), Überwachung nach dem Inverkehrbringen, MDR-Klassifizierung oder die Erstellung Ihrer technischen Dokumentation anbieten. Wir können Sie auch bei der Auswahl Ihrer benannten Stelle unterstützen, falls Sie eine benötigen. Um die neuesten gesetzlichen Änderungen zu erfüllen, können wir Ihre MD-Klassifizierung bestätigen, Ihre Bewertung der biologischen Sicherheit aktualisieren oder die Lücke zwischen Ihrem aktuellen System und den neuen Vorschriften analysieren. Wenn Sie ein Medizinprodukt ohne medizinische Zweckbestimmung verkaufen möchten, können wir Sie ebenfalls von A bis Z unterstützen.
Wenn Sie mit uns zusammenarbeiten, werden Sie Zeit und Geld sparen! Sie haben einen besonderen Wunsch? Zögern Sie nicht, sich mit uns in Verbindung zu setzen, um maßgeschneiderte Lösungen zu finden: info@biorius.com


