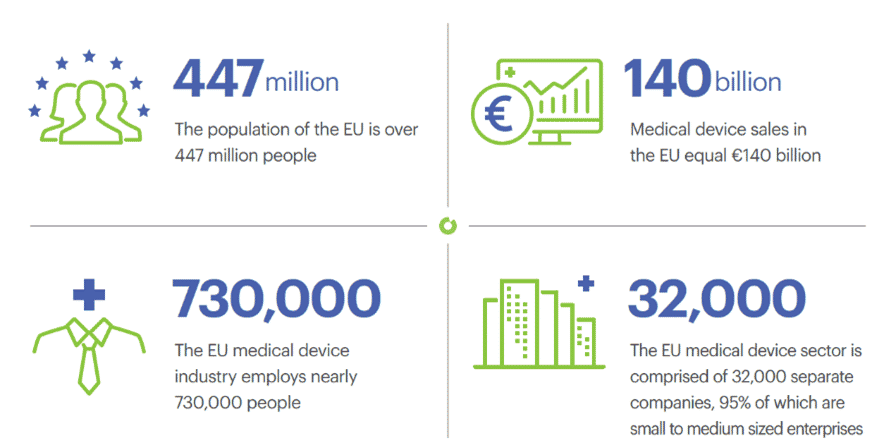
I dispositivi medici rappresentano un settore molto complesso in Europa, che produce miliardi di profitti. Le varietà e le categorie sono numerose, mentre il loro utilizzo comporta sempre un’alta posta in gioco per la sicurezza delle persone. Tutti questi fattori rendono il quadro dei dispositivi medici confuso, soprattutto perché in continua evoluzione. L’UE sta attualmente modificando profondamente le normative sui dispositivi medici e i marchi dovrebbero prestare seriamente attenzione all’impatto che avrà sulla loro attività nei prossimi anni.
D’altra parte, gli strumenti di bellezza stanno riscuotendo un maggiore interesse da parte dei consumatori europei, desiderosi di provare le più recenti tecnologie disponibili sul mercato. Gli strumenti di bellezza possono essere classificati come Dispositivi Medici, Dispositivi Medici senza uno scopo medico previsto o Prodotti di Uso Generale, rendendo la loro categorizzazione un primo passo nel processo di commercializzazione e sviluppo. Se il tuo strumento di bellezza è un Dispositivo Medico con o senza finalità mediche, sarà regolamentato da una serie di normative complesse con un lungo iter da seguire prima di poterlo vendere. Immergiamoci in questo affascinante argomento, che rimane complicato anche per i professionisti del settore! Con i suoi esperti dedicati ai Dispositivi Medici, BIORIUS è sempre al corrente degli ultimi sviluppi in Europa.
Strumenti di bellezza: come sapere se sono dispositivi medici nell’UE?
Anche se la categorizzazione degli strumenti di bellezza sembra essere un compito facile all’inizio, molti marchi stanno lottando con questa domanda chiave.
Secondo gli standard dell’UE, un Il dispositivo medico deve rispondere a un problema medico o a una malattia, che verrebbe curata, trattata o diagnosticata grazie all’azione del dispositivo. La modalità di funzionamento deve essere fisica perché non si deve fare confusione tra un Dispositivo Medico e un farmaco. Mentre la sua azione ausiliaria può essere medicinale o metabolica (per esempio, distribuire un farmaco nell’organismo), il suo scopo principale non lo è.
Di conseguenza, la prima domanda che dovresti porti per classificare il tuo strumento di bellezza è: Il mio prodotto presenta un’asserzione medica e affronta fisicamente il problema?
- Esempio di strumento di bellezza classificato come dispositivo medico: Maschera a luce LED che previene l’acne grave o la rosacea.
- Esempio di strumento di bellezza classificato come prodotto di uso generale: Rullo per il viso a microcorrente
ATTENZIONE: la definizione di Dispositivo Medico non è la stessa in tutto il mondo. Cina, Stati Uniti e altri paesi hanno standard diversi; negli Stati Uniti, ad esempio, i rulli per il viso a microcorrente sono classificati come dispositivi medici (codice prodotto OUH).
Regolamenti UE sui dispositivi medici e dispositivi medici privi di finalità medica
I nuovi regolamenti UE sui dispositivi medici
All’interno dell’Unione Europea, i dispositivi medici sono suddivisi in due diverse categorie: Dispositivi Medici “normali” (MDR) e Dispositivi Medici Diagnostici in Vitro (IVDR). Il loro quadro giuridico è stato drasticamente modificato nel 2017, quando sono stati adottati due nuovi regolamenti: il Regolamento (UE) 2017/745 per gli MDR e il Regolamento (UE) 2017/746 per gli IVDR. L’obiettivo era quello di adattarsi ai cambiamenti tecnologici contemporanei, di rafforzare le regole, di evitare qualsiasi interpretazione e di armonizzare le pratiche tra l’UE e i paesi internazionali.
E il Regno Unito? Sono applicabili nel Regno Unito come misura temporanea. Le autorità del Regno Unito stanno attualmente decidendo un regolamento specifico che sostituisca quelli dell’UE, mentre un marchio diverso inizierà a essere richiesto a partire da luglio 2023 (UKCA).
Gli strumenti di bellezza e i cosmetici classificati come Dispositivi Medici sono considerati MDR, ma vengono fatte ulteriori distinzioni tra loro. Infatti, le MDR sono classificate in Classe I, Classe IIa, Classe IIb e Classe III, da basso ad alto rischio. Ogni classificazione comporta requisiti specifici, come gli obblighi del produttore, l’obbligo di un organismo notificato o la registrazione aggiuntiva in alcuni Stati membri dell’UE.
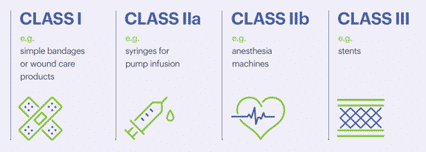
I tuoi strumenti di bellezza o i tuoi cosmetici possono essere classificati dalla Classe I alla Classe III, la più regolamentata e lunga. Se vuoi un supporto per definire la classificazione del tuo prodotto, BIORIUS è qui per aiutarti.
Per questo motivo, i marchi devono tenere conto dei requisiti specifici della classe, nonché delle nuove normative entrate in vigore di recente con un periodo di adattamento fino al 2025. Tuttavia, il famigerato allegato XVI del Regolamento (UE) 2017/745 non è ancora stato attuato, ma cambierà drasticamente il volto del mercato europeo per i produttori interessati…
Dispositivi medici senza scopo medico
Oltre alla definizione fornita in precedenza, un Dispositivo Medico può non avere alcuno scopo medico. Questa categoria limite riguarda i cosmetici e gli strumenti di bellezza che inizialmente mostrano un’azione estetica o uno scopo medico “nascosto” come estetico. Per motivi di sicurezza, nell’allegato XVI del Regolamento (UE) 2017/745 sono stati aggiunti 6 gruppi di prodotti da considerare come Dispositivi Medici senza scopo medico. Ogni classificazione sarà soggetta a requisiti specifici. L’allegato XVI non è ancora ufficialmente disponibile perché mancano ancora i requisiti specifici (specifiche comuni), ma si pensa che verrà rilasciato entro la fine del 2022.
Abbiamo già scritto un articolo su questo argomento, ma per ricordartelo ecco i 6 prodotti oggetto di questo allegato:
- Lenti a contatto o altri oggetti da introdurre nell’occhio.
- Prodotti destinati ad essere introdotti totalmente o parzialmente nel corpo umano attraverso mezzi chirurgicamente invasivi allo scopo di modificare l’anatomia o fissare parti del corpo, ad eccezione dei prodotti per tatuaggi e piercing –> Impianti…
- Sostanze, combinazioni di sostanze o articoli destinati a essere utilizzati per il riempimento del viso o di altre membrane dermiche o mucose mediante iniezione sottocutanea, sottomucosa o intradermica o altra introduzione, escluse quelle del tatuaggio –> Filler dermici, strumenti per il micro needling e la mesoterapia.
- Apparecchiature destinate a essere utilizzate per ridurre, rimuovere o distruggere il tessuto adiposo, come le apparecchiature per la liposuzione, la lipolisi o la lipoplastica.
- Apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità destinate all’uso sul corpo umano, comprese le sorgenti coerenti e non coerenti, monocromatiche e ad ampio spettro, come i laser e le apparecchiature a luce pulsata intensa, per il resurfacing della pelle, la rimozione di tatuaggi o peli o altri trattamenti cutanei–> Dispositivi di rimozione dei peli a LED.
- Apparecchiature destinate alla stimolazione cerebrale che applicano correnti elettriche o campi magnetici o elettromagnetici che penetrano nel cranio per modificare l’attività neuronale nel cervello –> Trattamento della depressione…

ATTENZIONE: all’Allegato XVI potrebbero essere aggiunte altre categorie di prodotti che possono comportare un rischio. Se il tuo cosmetico o strumento di bellezza è incluso nell’Allegato XVI o se ritieni che potrebbe esservi incluso in futuro, devi prepararti a diventare conforme fin da ora.
Se vendo cosmetici o strumenti di bellezza considerati Dispositivi Medici, ho tempo per conformarmi ai nuovi regolamenti UE e all’Allegato XVI?
La risposta è sì, grazie ai periodi di transizione. Sono stati implementati per concederti un tempo sufficiente per decidere di procedere e iniziare a condurre gli studi richiesti e per apportare le modifiche necessarie. Tuttavia, devi sapere che:
- Tutti i marchi e i produttori hanno tempo fino al 2024 prima che il loro certificato rilasciato in base alla vecchia normativa sui dispositivi medici perda la sua validità. Migliaia di aziende stanno già cercando di conformarsi al Regolamento (UE) 2017/745 e altre migliaia aspetteranno l’ultimo minuto per farlo. È prevedibile che i tempi del processo siano più lunghi, già 18 mesi in media.
- Anche i produttori di cosmetici e strumenti di bellezza dovranno conformarsi all’Allegato XVI una volta implementato, ma al momento ci sono ancora delle incertezze. Quindi, se aspetti fino all’ultimo momento, come altre migliaia di aziende, i tempi lunghi del processo potrebbero impedirti di immettere il tuo prodotto sul mercato secondo la scadenza iniziale.
L’insieme di questi due fattori fa sì che l’approvazione da parte dell’Organismo Notificato (se ne hai bisogno) possa richiedere anche diversi anni. Infatti, oltre al sovraccarico di lavoro degli Organismi Notificati e alla fretta prevista, i Dispositivi Medici senza uno scopo medico previsto non sono la priorità. I dispositivi medici regolari, essenziali per la sicurezza delle persone o per l’assistenza sanitaria, saranno trattati per primi, mentre gli altri potrebbero essere l’ultimo della fila.

Non aspettare! BIORIUS può aiutarti a sviluppare il tuo MD fornendoti i servizi di responsabile UE/UK (per le aziende con sede fuori dall’Europa), sorveglianza post-market, classificazione MDR o creazione della documentazione tecnica. Possiamo anche assisterti nella scelta del tuo Organismo Notificato, se ne hai bisogno. Per essere conformi alle ultime modifiche normative, possiamo confermare la tua classificazione MD, aggiornare la tua valutazione di biosicurezza o analizzare il divario tra il tuo sistema attuale e le nuove normative. Se vuoi vendere un Dispositivo Medico senza uno scopo medico, possiamo anche fornirti assistenza dalla A alla Z.
Lavorare con noi ti farà risparmiare tempo e denaro! Hai una richiesta speciale? Non esitare a contattarci per mettere in atto soluzioni su misura: info@biorius.com


