Retinol und Retinylester – Ein neuer Ansatz für den Umgang mit diesen Inhaltsstoffen
16. Mai 2017
Retinol und seine Ester (Retinylacetat, Retinylpropionat und Retinylpalmitat) sind Wirkstoffe, die häufig in Anti-Aging-Hautpflegeprodukten enthalten sind.
Wie unten mitgeteilt, wurden Retinol und die drei oben genannten Ester vom SCCS (Wissenschaftlicher Ausschuss für Verbrauchersicherheit) bewertet. Das wissenschaftliche Gutachten, das im Oktober 2016 abgeschlossen wurde, kam zu dem Schluss, dass Retinol (in Kombination mit seinen Estern) bei einer Verwendung von maximal 0,3 % in Gesichtscremes, Handcremes und Rinse-off-Produkten sicher ist. Eine maximale Konzentration von 0,05 % wurde bei der Verwendung in Körperlotionen als sicher angesehen.
BIORIUS hat dieses wissenschaftliche Gutachten sorgfältig ausgewertet und neigt dazu, den darin enthaltenen Schlussfolgerungen nicht zuzustimmen, da sie als übermäßig konservativ angesehen werden. Obwohl das Gesetz vorschreibt, dass BIORIUS die Stellungnahmen des SCCS bei seinen Bewertungen berücksichtigen muss, sind diese wissenschaftlichen Dossiers keine Gesetzestexte und können mit einer gewissen Flexibilität umgesetzt werden. Diese Inhaltsstoffe werden nicht vor 2 oder 3 Jahren reguliert. In der Zwischenzeit plant BIORIUS, eine besondere Strategie zu verfolgen. Hier sehen Sie eine Illustration dieser Strategie für eine Gesichtscreme:
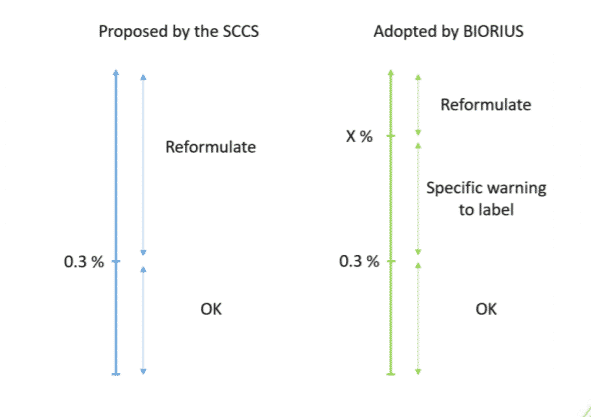
“X” steht für die maximale Konzentration der Summe von Retinol und seinen Estern, die in einem kosmetischen Produkt sicher verwendet werden kann. Dieser Prozentsatz variiert je nach Produktkategorie. Um diesen Prozentsatz genau zu berechnen, können Sie diese Excel-Tabelle öffnen und den Anweisungen folgen. Zum Beispiel: X = 1,25 %, wenn nur Retinol in der Gesichtscreme verwendet wird.
Wenn der prozentuale Anteil von Retinol und seinen Estern über der Konzentration von 0,3 % und unter dem sicheren Höchstwert (X) liegt, muss auf dem Etikett die besondere Warnung “Verwenden Sie dieses kosmetische Mittel während Ihrer Behandlung nicht zusammen mit anderen retinolhaltigen kosmetischen Mitteln” hinzugefügt werden. Dieser Satz wäre weniger beunruhigend als der derzeitige Warnhinweis “Während der Schwangerschaft vermeiden”. Für bereits gemeldete Produkte empfehlen wir, den bisherigen Warnhinweis durch den neuen Wortlaut zu ersetzen.
Diese Lösung ist die beste Lösung, die unsere Toxikologen gefunden haben, um die Folgen dieses SCCS-Gutachtens abzumildern. Es ist jedoch anzumerken, dass diese Lösung nur vorübergehend ist und die Beschränkungen strikt angewandt werden müssen, wenn die SCCS-Stellungnahme in die Gesetzgebung umgesetzt wird.
Wir empfehlen Ihnen, sich mit dieser Excel-Tabelle vertraut zu machen und sich an uns zu wenden, wenn Sie Fragen zu dieser neuen Methode der Risikobewertung/Risikomanagement haben.
Haben Sie Fragen?
Veröffentlichung des Entwurfs der SCCS-Stellungnahme zu Retinol und Retinylestern
6. Mai 2016
Wie in diesem Artikel (10) erwähnt, sind Retinol und Retinylester derzeit auf dem Tisch des SCCS, der für die Bewertung ihrer sicheren Verwendung in kosmetischen Produkten zuständig ist. Im Auftrag der EU-Kommission durfte der SCCS nur die gestellten Fragen beantworten, wobei die wichtigste Frage lautete:
Auf der Grundlage der vorgelegten Daten hält der Wissenschaftliche Ausschuss für Verbrauchersicherheit (SCCS) Vitamin A (Retinol, Retinylpalmitat, Retinylacetat, Retinyllinoleat und Retinal) bei der Verwendung als kosmetischer Inhaltsstoff für sicher:
a) in Körperlotionen bis zu einer maximalen Konzentration von 0,05 % Retinol-Äquivalent?
b) in Hand-/Gesichtscreme, Leave-on-Produkten (ausgenommen Körperlotionen) und Rinse-off-Produkten bis zu einer Konzentration von 0,3 % Retinol-Äquivalent?
In seinem wissenschaftlichen Gutachten kam der SCCS zu dem Schluss, dass 0,05% Retinol-Äquivalent in Körperlotionen und 0,3% in Hand-/Gesichtscreme, Leave-on-Produkten (außer Körperlotionen) und Rinse-off-Produkten unbedenkliche Verwendungsmengen sind.
Die gute Nachricht ist, dass der SCCS nicht beantragt hat, diese Verbrauchswerte zu senken. Die schlechte Nachricht ist, dass die EU-Kommission diese eher niedrigen Konzentrationen von 0,05% und 0,3% wahrscheinlich als Grundlage für die Entwicklung ihrer Risikomanagementmaßnahme verwenden wird. Sofern die Industrie keine Bedenken äußert, wird ein neuer Eintrag in Anhang III der EU-Kosmetikverordnung geschaffen, um die Verwendung von Retinol und Retinylestern auf diese Konzentrationen zu beschränken.
Dieses wissenschaftliche Gutachten liegt noch bis zum 21. Juni 2016 als Entwurf vor. Sie können sich an der öffentlichen Konsultation beteiligen, um Sicherheitsdaten zu liefern, die die Schlussfolgerungen dieser Risikobewertung ändern könnten.
Wenn ja, lassen Sie es uns bitte so bald wie möglich wissen. Biorius wird die Kommentare sammeln und sie an die EU-Kommission weiterleiten.

