Die Grenze zwischen einem kosmetischen Produkt und einem Medizinprodukt
Eine wichtige Änderung in der Verordnung (EU) 2017/745 über Medizinprodukte (MDR) ist die Aufnahme von 6 Produktgruppen in den Anwendungsbereich: die in Anhang XVI aufgeführten “Kosmetischen Mittel”, die wie folgt lauten:
LISTE DER GRUPPEN VON PRODUKTEN OHNE MEDIZINISCHE ZWECKE GEMÄSS ARTIKEL 1 ABSATZ 2
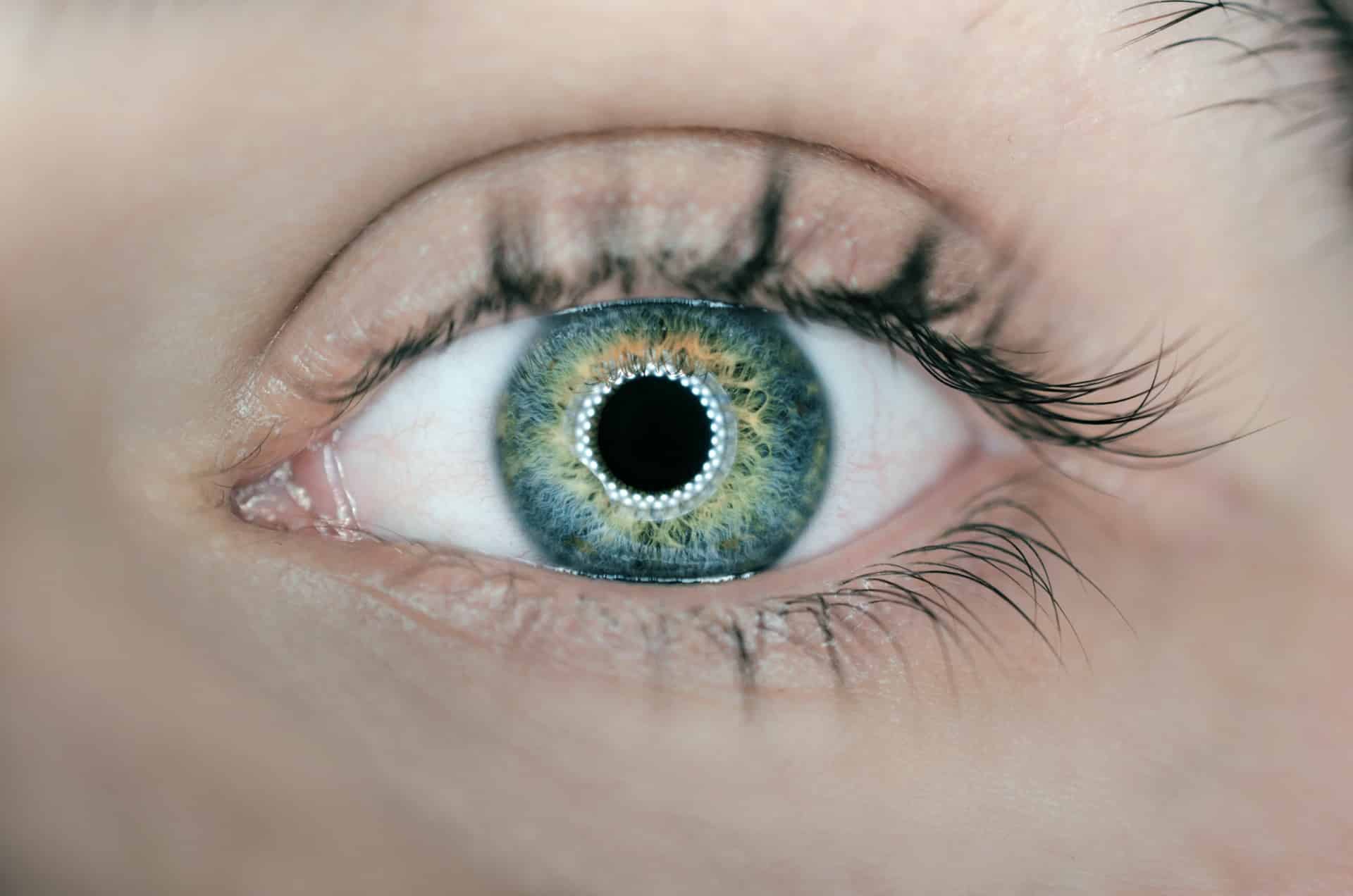
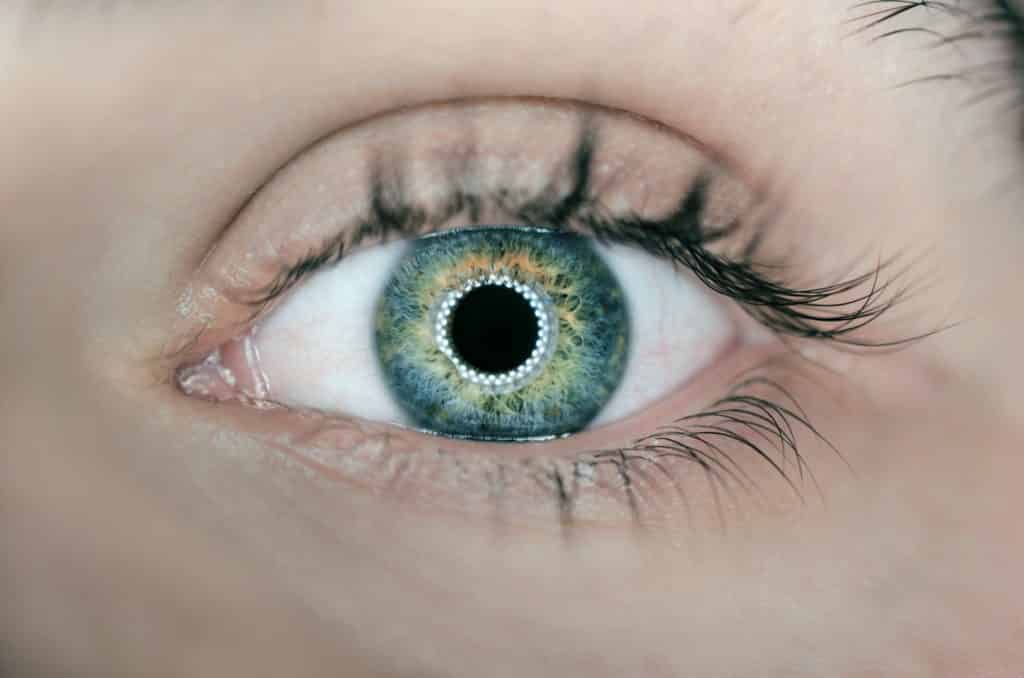
- Kontaktlinsen oder andere Gegenstände, die dazu bestimmt sind, in oder auf das Auge eingeführt zu werden.
- Produkte, die dazu bestimmt sind, ganz oder teilweise durch chirurgische Eingriffe in den menschlichen Körper eingeführt zu werden, um die Anatomie zu verändern oder Körperteile zu fixieren, mit Ausnahme von Tätowierungsprodukten und Piercings.
- Stoffe, Stoffkombinationen oder Gegenstände, die dazu bestimmt sind, durch subkutane, submuköse oder intradermale Injektion oder auf andere Weise in das Gesicht oder andere Haut- oder Schleimhautbereiche eingebracht zu werden, mit Ausnahme von Stoffen, die zum Tätowieren verwendet werden.
- Geräte, die dazu bestimmt sind, Fettgewebe zu reduzieren, zu entfernen oder zu zerstören, wie z.B. Geräte zur Fettabsaugung, Lipolyse oder Lipoplastie.
- Geräte, die elektromagnetische Strahlung hoher Intensität (z.B. Infrarot, sichtbares Licht und Ultraviolett) emittieren und für die Anwendung am menschlichen Körper bestimmt sind, einschließlich kohärenter und nicht-kohärenter Quellen, monochromatischer und breitbandiger Strahlung, wie z.B. Laser und Geräte mit intensiv gepulstem Licht, für die Hauterneuerung, die Entfernung von Tätowierungen oder Haaren oder andere Hautbehandlungen.
- Geräte zur Hirnstimulation, die elektrische Ströme oder magnetische oder elektromagnetische Felder anwenden, die in den Schädel eindringen, um die neuronale Aktivität des Gehirns zu verändern.
Während einige der aufgeführten Produkte leicht zu identifizieren sind, wie z.B. “dekorative” Kontaktlinsen, ist es aufgrund der verwendeten Formulierungen etwas schwierig zu verstehen, um welche Produkte es sich handelt. Wir werden zunächst versuchen, diesen Punkt zu klären.
DIE IN ARTIKEL 1 ABSATZ 2 GENANNTEN GRUPPEN VON ERZEUGNISSEN OHNE MEDIZINISCHE ZWECKBESTIMMUNG
Kontaktlinsen oder andere Gegenstände, die dazu bestimmt sind, in oder auf das Auge eingeführt zu werden.
Bei diesen Geräten handelt es sich um ‘dekorative’ Linsen, mit denen Sie die Farbe Ihrer Augen ändern können, z.B. von braun zu blau oder um Augapfelpiercings, wie auf dem Bild zu sehen.
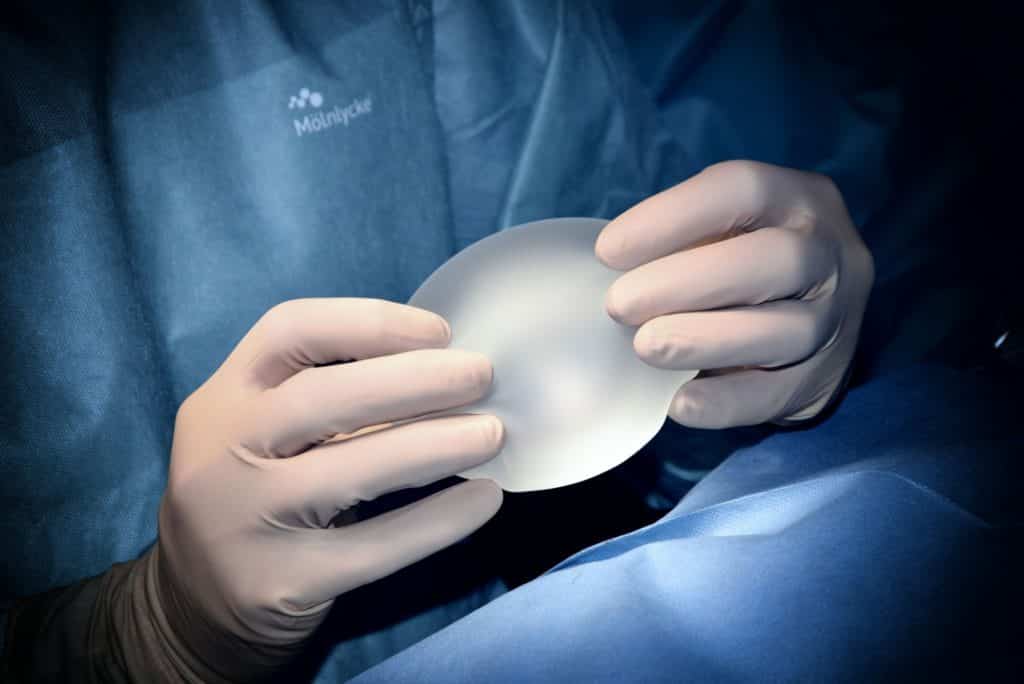
Produkte, die dazu bestimmt sind, ganz oder teilweise durch chirurgisch-invasive Eingriffe in den menschlichen Körper eingeführt zu werden, um die Anatomie zu verändern oder Körperteile zu fixieren, mit Ausnahme von Tätowiermitteln und Piercings.
Dabei handelt es sich um Brustimplantate, die für die Vergrößerung der weiblichen Brust verwendet werden, aber auch um alle Arten von Implantaten für Männer wie Bizeps-, Waden- oder Brustmuskelimplantate sowie andere Implantate im Gesicht, um das Aussehen zu verändern.
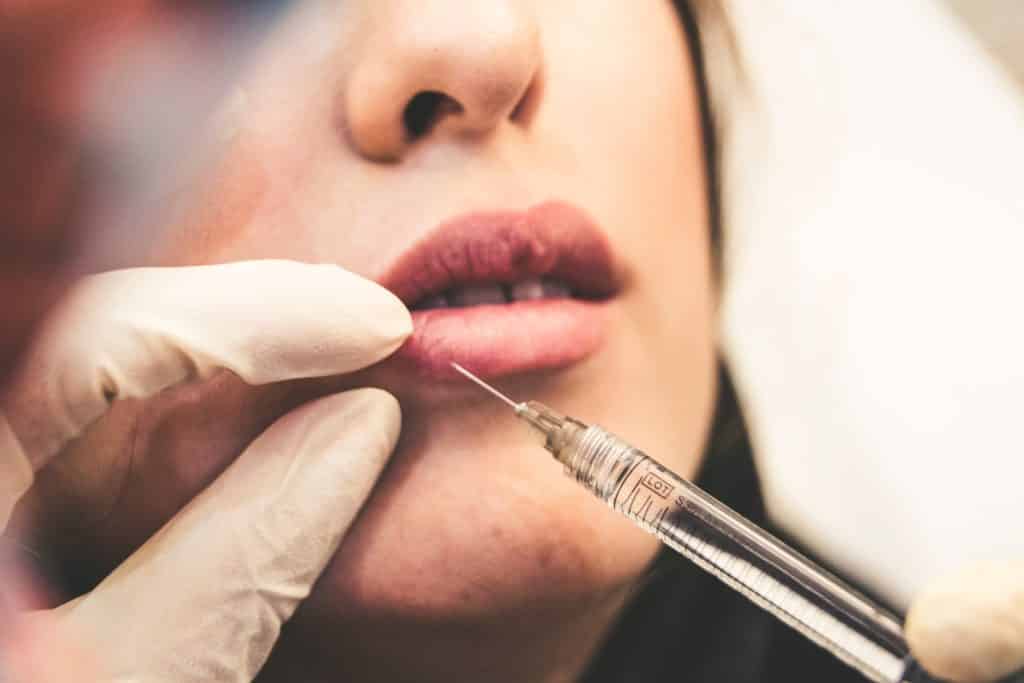
Stoffe, Stoffkombinationen oder Gegenstände, die dazu bestimmt sind, durch subkutane, submuköse oder intradermale Injektion oder auf andere Weise in das Gesicht oder andere Haut- oder Schleimhautbereiche eingebracht zu werden, mit Ausnahme von Stoffen, die zum Tätowieren verwendet werden.
Diese Produkte werden als “Dermal Filler” bezeichnet und sind injizierbare Implantate, die in Schönheitskliniken häufig zur Beseitigung von Falten, zum Aufpolstern der Lippen und anderer Bereiche des Gesichts verwendet werden, aber auch im Genitalbereich eingesetzt werden können. Ein berühmter Inhaltsstoff ist Hyaluronsäure. Aber was sind diese Substanzen, die für das Gesicht und die Haut bestimmt sind, wenn man von “anderer Einführung” spricht? Sind Mesotherapieprodukte die Zielprodukte? Wenn das so ist, gibt es in dieser Praxis viel zu tun.
Geräte, die dazu bestimmt sind, Fettgewebe zu reduzieren, zu entfernen oder zu zerstören, wie z.B. Geräte zur Fettabsaugung, Lipolyse oder Lipoplastie
Dies sind Geräte, die für die Fettabsaugung verwendet werden, aber auch solche, die Kryothermie oder andere Techniken verwenden.
Geräte, die elektromagnetische Strahlung hoher Intensität (z.B. Infrarot, sichtbares Licht und Ultraviolett) emittieren und für die Anwendung am menschlichen Körper bestimmt sind, einschließlich kohärenter und nicht-kohärenter Quellen, monochromatischer und breitbandiger Strahlung, wie z.B. Laser und Geräte mit intensiv gepulstem Licht, für die Hauterneuerung, die Entfernung von Tätowierungen oder Haaren oder andere Hautbehandlungen.
Diese Geräte verwenden Licht, um auf Haare oder Haut einzuwirken. Eine der Schwierigkeiten hierbei ist das Fehlen einer detaillierten Definition für solche Geräte, z.B. wie hoch ist die Lichtstrahlung, die als hochintensiv anzusehen ist?

Geräte zur Hirnstimulation, die elektrische Ströme oder magnetische oder elektromagnetische Felder anwenden, die in den Schädel eindringen, um die neuronale Aktivität des Gehirns zu verändern.

Diese Geräte sind zur Behandlung von Depressionen, zur Schmerzlinderung oder zur Stimulierung der Gehirnkapazität ohne medizinischen Zweck gedacht. Sie können dazu elektrischen Strom, magnetische oder elektromagnetische Felder verwenden.
Ästhetische oder medizinische Zwecke? Was steht in der neuen Verordnung?
In der Tat können einige dieser Produkte ohne medizinische Zwecke in der Regel mit dem CE-Kennzeichen versehen sein, und ihre Hersteller sind bereits mit den Konformitätsbewertungen der benannten Stelle vertraut. Dasselbe gilt für Brustimplantate, Dermal Filler und IPL-Geräte. Für diese Geräte gibt es sowohl medizinische als auch nicht-medizinische Anwendungen. Die Klarstellung in Anhang XVI war notwendig, weil die Richtlinien in einigen EU-Ländern unterschiedlich angewandt werden und Produkte, die als Medizinprodukte gelten, in anderen Ländern nicht in diese Kategorie fallen. Durch die einheitliche Anwendung der neuen Verordnung für alle EU-Mitgliedstaaten gelten überall in der Europäischen Union die gleichen Regeln.
Darüber hinaus wird diese Änderung der bekannten Heuchelei ein Ende setzen, die die Hersteller dazu bringt, den Verwendungszweck zu verdrehen, indem sie eine medizinische Indikation vortäuschen, obwohl die meisten ihrer Produkte rein ästhetischen Zwecken dienen. Zum Beispiel waren Brustimplantate für die Brustrekonstruktion nach einer Mastektomie aufgrund von Krebs indiziert, aber viele von ihnen wurden zur Brustvergrößerung verkauft. Die Hersteller von Dermalfüllern mussten Patienten mit sehr spezifischen Krankheiten finden, als ihre Geräte hauptsächlich für Frauen in einer bestimmten Altersgruppe verwendet wurden. Die Hersteller müssen nicht mehr den klinischen Nutzen darlegen, sondern können sich auf den Nachweis der klinischen Sicherheit beschränken.
Bei dekorativen Kontaktlinsen sieht die Sache anders aus, da ihre Hersteller bisher nicht von den Vorschriften für Medizinprodukte betroffen waren. Sie müssen die Sicherheit ihres Produkts nachweisen, ein Qualitätsmanagementsystem einführen und ihre Dokumentation drastisch ändern. In der Tat müssen sie die Verordnung genauso erfüllen wie die Hersteller von Kontaktlinsen, mit Ausnahme des Nachweises des klinischen Nutzens, der sich auf den Sicherheitsteil beschränken wird. Für jede Gruppe von Produkten werden die Normen gelten, die für ähnliche Technologien existieren: So werden beispielsweise die Normen für korrigierende Kontaktlinsen auch für dekorative Kontaktlinsen gelten.
Ab wann werden diese neuen Regeln gelten?
Ursprünglich war geplant, die Gemeinsamen Spezifikationen vor dem 26. Mai 2021, dem Datum der Anwendung der Verordnung, zu veröffentlichen und den Herstellern eine Frist von 6 Monaten einzuräumen, um die Anforderungen zu erfüllen. Bis heute (Dezember 2021) wurde jedoch keine gemeinsame Spezifikation zu diesem Thema veröffentlicht, und angesichts des Mangels an Ressourcen der benannten Stelle hat dieses Thema für die Europäische Kommission möglicherweise keine hohe Priorität.
Ist “Abwarten” eine Option? Wahrscheinlich nicht, denn die Vorbereitung auf diese Verordnung kann zwischen 12 und 36 Monaten dauern, je nachdem, wo Sie anfangen, welche Ressourcen Sie dafür aufwenden können und wie verfügbar die gewählte benannte Stelle ist. Der in der Verordnung vorgesehene Zeitraum von 6 Monaten für die Vorbereitung darauf wurde weitgehend unterschätzt.
Es ist also an der Zeit, sich mit Biorius in Verbindung zu setzen, um Ihre Produkte und Ihr Unternehmen auf diese wichtigegesetzliche Änderung vorzubereiten.