ここでは、市販後調査(PMS)と市販後臨床フォローアップ(PMCF)に関する重要なポイントを簡単に説明します。
市販後調査(PMS)の定義
市販後調査(PMS)とは、製造者が他の経済事業者*と協力して、市場に投入された機器、市販された機器、または使用された機器の使用状況を把握し、予防措置または是正措置を直ちに適用する必要性を特定するために、体系的かつ事前のデータ収集手順を確立して最新の状態に保つために行うすべての活動を指します。
PMSシステムは、機器のリスククラスを考慮し、機器ごとに製造者が計画、確立、文書化、実施、維持、更新しなければならず、製造者の品質管理システムの一部でなければなりません。
PMSのイメージ図:
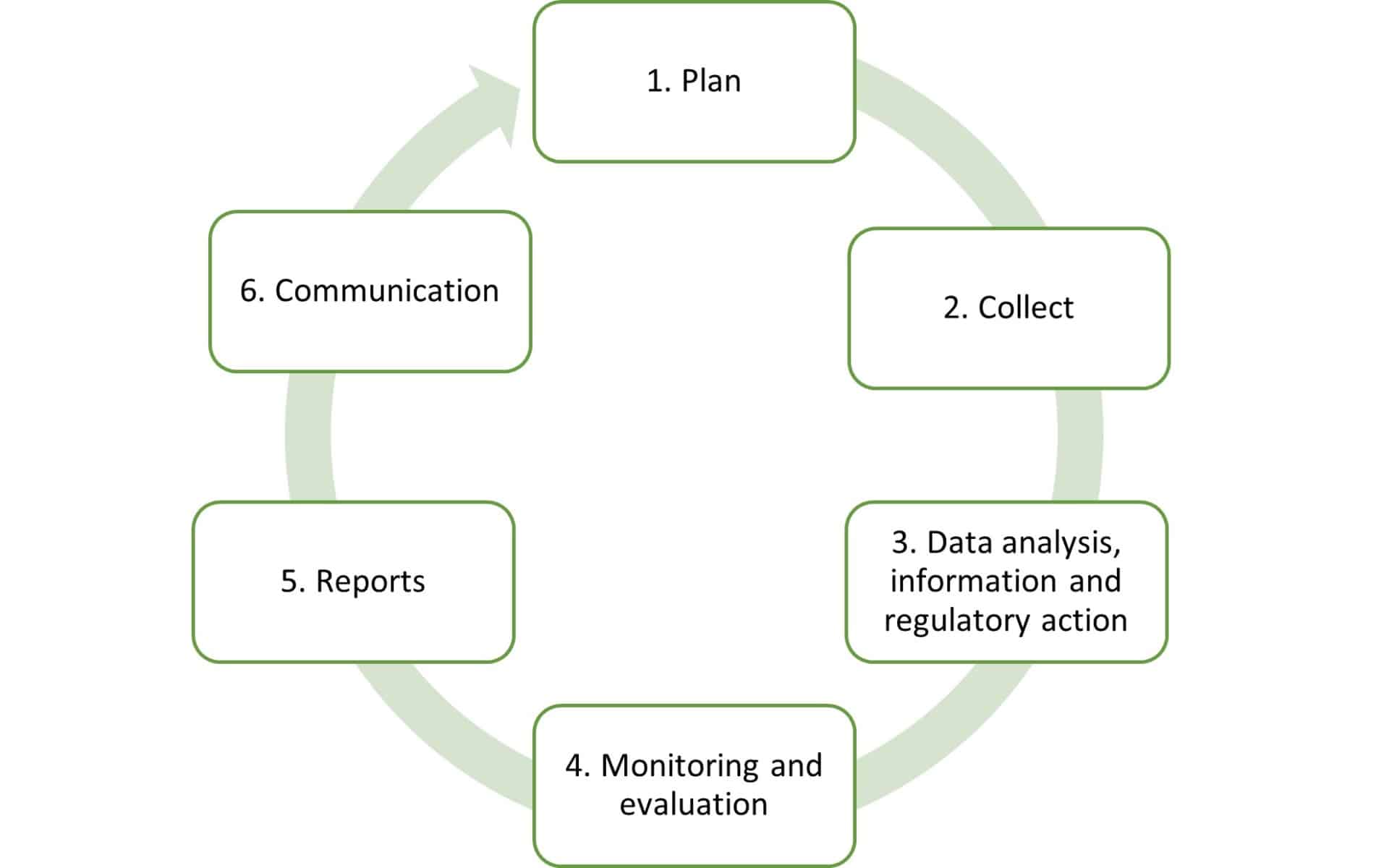
1. 市販後調査計画
- プロアクティブアクションとリアクティブアクションの決定
- データ収集方法の定義
- データ解析方法の定義
- 限界と指標
2. データの収集
以下に関するすべての情報を収集:
- インシデント
- 副作用
- 傾向に関するレポート
- 苦情
- 市販後臨床フォローアップ
- 文献からのデータ
- 競合製品のデータ
3. データの分析、情報、規制措置(定期的措置):
収集されたデータはすべて分析され、必要に応じて所轄官庁に通知することが決定されます。
4. モニタリングと評価
- 市販後調査の性能測定
- 性能と安全性の評価
5. レポート
市販後調査計画の実施により、機器のクラスに応じて3種類のレポートが作成されます:
- 製造販売後調査報告書
- 安全性定期報告書(PSUR)
- 安全性と臨床成績の要約(SSCP)
6. 一般コミュニケーション
- 社内コミュニケーションとマネジメントレビュー
- 外部コミュニケーション:ノーティファイドボディ、所轄官庁、EUDAMED
直接リンクされた3つのレポートに加え、PMSデータでは以下のことが可能:
- 臨床評価報告書(CER)または性能評価報告書(PER)の更新
- トレンドの検出と報告により、ベネフィット/リスク比率の更新
- 改善可能性(機器の使いやすさ、性能、安全性)を把握し、設計・製造、使用説明書、ラベル表示に関する情報の更新
- セキュリティの是正措置(CAPAまたはFSCA)の必要性を特定し、リスクマネジメントを改善
PMCFはPMSに含まれます
このPMSシステムの枠組みの中で、PMCF(市販後臨床フォローアップ)活動はCERを更新する継続的なプロセスとして考えられているため、PMCFはPMS計画の一部として不可欠なものとなっています。
CEマーキング後の臨床フォローアップであるPMCFは、医療機器の性能や安全性に関する臨床評価やCERに既に存在する臨床データを確認するために、実際の臨床データを収集することで構成されています。
PMCFの更新方法:
臨床データの更新として、以下のようないくつかの方法を検討する必要があります:
- マテリオビジランスの系統的レビュー
- 文献の更新:
- 当該医療機器について
- 類似の医療機器について(「類似性」には注意が必要)
- 代替治療について
- 臨床フォローアップにおける臨床データの積極的な収集:PMCFスタディー
PMCFスタディーの実施は、機器が患者にとって高いリスクを伴う場合、あるいは臨床データが完全でない場合に必須となります:
- 利用可能な臨床データが、デバイスの寿命をカバーしていない
- 臨床データを対象者全体に適応することができない
- リスク分析で未チェックの臨床リスクがある
PMSやPMCFの導入に際してサポートが必要な場合は、お気軽にお問い合わせください。

*経済事業者:MDRでは、製造業者、輸入者、販売者、および公認の責任者と定義されています。

