ヨーロッパ・イギリスで販売するために必要な4つの条件
まず、ヨーロッパとイギリスで化粧品を販売するためには何が必要かを再確認しましょう。すでに「EU化粧品規制:準拠への3ステップ」の記事でご紹介したように、以下の4つの条件が必要となります。
- 製品情報ファイル(PIF)。PIFに関する詳しい説明は、こちらの記事をご覧ください。
- 規制に準拠した製品ラベルと訴求。
- 欧州のポータルサイト(CPNP)、およびイギリスで販売する場合はイギリスのポータルサイト(SCPN)への届出。
- 最後に法的代理人、すなわちEUおよびイギリスに拠点を置く責任者です。
上記4つの要件のうち1つでも欠けていれば、化粧品ブランドは、ヨーロッパ・イギリスでビジネスをすることが出来ません。
BIORIUSでは、このプロセスを一貫してお手伝いします。プロセスの詳細、およびBIORIUSの有するEU規制に関する専門知識については、こちらの記事をご参照ください。
化粧品製品安全性報告書(CPSR)について
この記事は、化粧品製品安全性報告書(CPSR)について、より明確な情報を提供することを目的としています。

CPSRはどこに含まれているか?
CPSRは、各化粧品の製品情報ファイル(PIF)を構成する一部分です。製品情報ファイルはいくつかのサブフォルダからなる電子ファイルで、その中にCPSRを含むファイル(通常はPDF)が存在します。
CPSRの重要性と各国管轄当局の監査
CPSRは、化粧品をヨーロッパ・イギリス市場に投入する際の最も重要な報告書であると言えます。ただし、製品情報ファイル(PIF)内のその他書類も同様に重要なので軽視はできません。製品ラベル、規制準拠した処方、ポータルサイトへの届け出、責任者なども、規制遵守に不可欠な要素です。
CPSRは、各国管轄当局によって最も監査をされる項目であるため、PIF内にCPSRがない、もしくは作成を怠った場合、非常に厳しい金銭的ペナルティや即時撤退、又はRAPEX*への通報につながる可能性があります。*RAPEXとは、EU各国当局の監督制度です。化粧品ブランドがRAPEXに登録されると、すべての製品について体系的で綿密な監査が行われることが予想されます。
CPSRにはどのような情報が必要か?
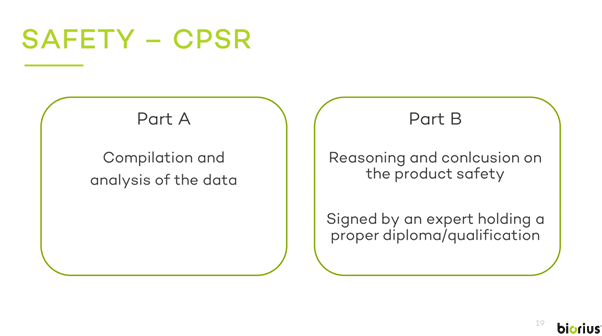
化粧品に関する2009年11月30日付欧州議会規則(EC)No1223/2009の付属書Iには、化粧品が人の健康に及ぼす危険性を特定・定量化するために、安全性評価者が収集・処理しなければならないすべての情報が明記されています。すなわち、2つのパート(PART A/PART B)に含まれなければいけない要素が詳細に記載されています。
PART A には、以下の「化粧品安全性情報」が含まれます。

- 化粧品の量的および質的組成。
- 化粧品の物理的・化学的特性及び安定性。
- 微生物学的品質
- 不純物、痕跡、包装材に関する情報。
- 通常かつ合理的に予見可能な使用。
- 化粧品への曝露。
- 物質への曝露。
- 物質の毒性プロファイル
- 好ましくない影響と深刻な悪影響。
- 化粧品に関する情報
一方、PART B には、以下の「化粧品安全性評価」が含まれます。

- 評価の結論:第3条に関連する化粧品の安全性に関するステートメント。
- 警告及び使用説明:第19条1項(d)に基づき、特定の警告及び使用説明を表示する必要性についてのステートメント。
- 推論:第 1 項及び第 2 項のステートメントに至った科学的根拠の説明。この説明は、PART A の記述に基づくものである。必要な場合は、安全性マージンを評価・検討するものとする。特に、3歳未満の小児に使用することを意図した化粧品及び外部の親密な衛生に使用することを意図した化粧品については、特定の評価を行うものとする。また、化粧品に含まれる物質の相互作用の可能性が評価されなければならない。異なる毒性学的プロファイルの考慮または非考慮は、適切に正当化されなければならない。安定性が化粧品の安全性に及ぼす影響も適切に考慮しなければならない。
- 評価者の資格とPART Bの承認。
CPSRについてよくある誤解
CPSRを語る上で、よくある誤解・間違いをいくつか挙げてみたいと思います。
- 成分の配合構成にのみ基づいて作成されている(原材料毎のブレークダウンに基づいていない)。
- 不純物が正しく認識されていない。
- 包装材の性質や評価は非常に限定的、あるいは皆無に等しい。
- 原材料に関する重要書類がない(例:香料のIFRA証明書など)。
- 試験の質が不十分であったり、否定的な試験結果が無視されるか過小評価されている。
- 個々の成分に関する毒性学的データが存在しないか、非常に限られている。
- 化粧品への曝露が楽観的であるか、あるいは完全に間違っている。
- 全身毒性のみが定量的に評価され、皮膚感作性、皮膚刺激性など他の毒性学的エンドポイントについては考慮されていない。
- 安全性評価者が適切な資格を持っていない。
- CPSRは製品とともに進化すべきなのに、作成時からアップデートされていない。
以上の事から、CPSRの作成については、誠実で信頼のおける機関に頼ることが重要になります。BIORIUSの安全性評価者は、CPSRのPART Bに署名できる必要な学位・資格を有しており、この責務を正しく遂行いたします。
CPSRおよびBIORIUSの提供するサービスに関するお問い合わせは、下記メールアドレスまでお気軽にご連絡ください。

Valeria Secco
Business Development Representative

